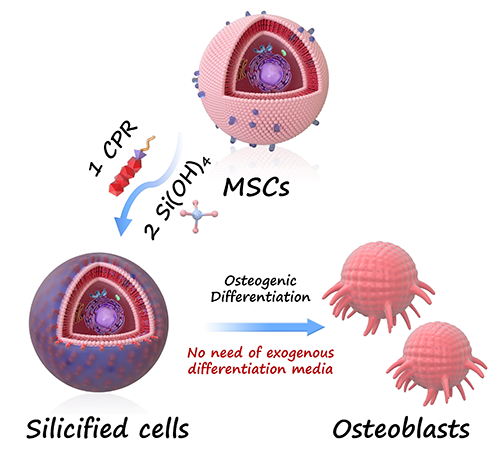
間充質(zhì)干細胞(MSCs)因其多向分化潛能,被廣泛應用于骨組織工程與再生醫(yī)學領(lǐng)域。當前主流的成骨誘導策略,普遍依賴骨形態(tài)發(fā)生蛋白(BMP-2)、地塞米松等外源成骨因子配合特定培養(yǎng)基,但此類方法存在成本高、副作用強、體內(nèi)效應不穩(wěn)定等難題,嚴重制約了其臨床轉(zhuǎn)化。如何在無外源誘導因子參與的條件下,實現(xiàn)高效、穩(wěn)定的成骨分化,成為干細胞應用研究的一大挑戰(zhàn)。
近日,華南理工大學生物科學與工程學院朱偉教授團隊與廣東省人民醫(yī)院陳洪林副教授團隊聯(lián)合,提出了一種全新的“界面硅化(Interfacial Silicification)”策略:通過人工設計的兩親性肽分子,在細胞膜表面原位催化硅前驅(qū)體沉積,直接誘導MSC分化為成骨細胞。該策略不僅完全擺脫了傳統(tǒng)成骨誘導培養(yǎng)體系的依賴,更在多種來源的MSC中展現(xiàn)出穩(wěn)定、通用的誘導效果。相關(guān)成果以“Interfacial Silicification Efficiently Drives Osteogenic Differentiation of Mesenchymal Stem Cells without Any Exogenous Osteoinductive Factor”為題,發(fā)表在國際頂級期刊《ACS Nano》上。
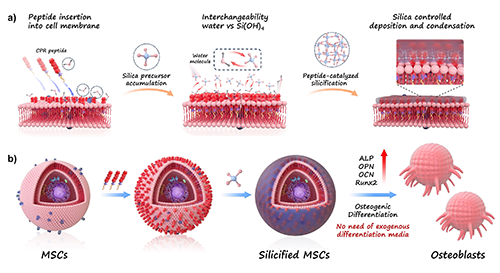
圖1. CPR肽驅(qū)動的界面硅化誘導MSC成骨分化示意圖。a)CPR肽嵌入MSC細胞膜,通過親疏水協(xié)同作用促使硅前驅(qū)體在細胞表面聚集并沉積;b)在無外源成骨誘導因子的條件下,經(jīng)界面硅化處理后的MSC成功誘導分化為成骨細胞。
為實現(xiàn)無因子驅(qū)動的成骨誘導,研究團隊設計出一種功能性兩親性多肽(CPR肽),其包含三個關(guān)鍵結(jié)構(gòu)域:N端棕櫚酸鏈用于錨定細胞膜、中央PEG間隔臂提升親水性與生物相容性,C端則引入源于硅藻肽的RRIL序列,具備高度親硅活性。該肽可自組裝插入MSC細胞膜,通過調(diào)控細胞界面與硅前驅(qū)體(如TEOS水解產(chǎn)物Si(OH)?)的動態(tài)交換,實現(xiàn)細胞膜原位硅沉積。
這一“界面硅化”過程有效改變了MSC的表面微環(huán)境,并引發(fā)一系列信號傳導變化,包括成骨相關(guān)因子(RUNX2、OPN、OCN等)的顯著上調(diào),最終促進MSC向成骨細胞表型的轉(zhuǎn)化。更重要的是,這一過程完全無需傳統(tǒng)誘導培養(yǎng)液,展現(xiàn)出優(yōu)異的通用性與操作簡便性。
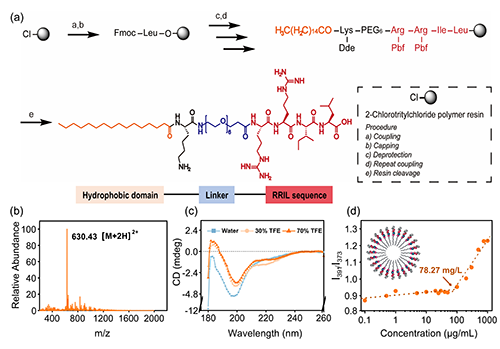
圖2. CPR功能肽的合成與結(jié)構(gòu)表征。a)CPR肽的合成流程圖;b)ESI質(zhì)譜驗證了肽鏈分子量的準確性;c)圓二色譜揭示其在疏水環(huán)境中趨向形成α-螺旋構(gòu)象;d)通過熒光探針法測定其CMC為78.27 mg/L,顯示其良好的自組裝能力。
為了實現(xiàn)“界面催化沉積”的設計構(gòu)想,研究團隊采用固相合成策略構(gòu)建了CPR肽分子,其結(jié)構(gòu)包括棕櫚酸疏水基、PEG?親水間隔段和具有強硅親和力的RRIL功能序列。通過質(zhì)譜檢測(ESI-MS),驗證了合成肽的分子量準確、結(jié)構(gòu)純凈;圓二色譜(CD)進一步揭示其在水相中呈現(xiàn)無序構(gòu)象,而在疏水環(huán)境中誘導α-螺旋結(jié)構(gòu)的形成,模擬了其在細胞膜嵌入狀態(tài)下的構(gòu)象轉(zhuǎn)變。
此外,熒光探針和CMC(臨界膠束濃度)測試顯示,CPR肽具備良好的自組裝能力,可穩(wěn)定聚集于膜表面,形成有序排列,為硅前驅(qū)體的吸附與聚合提供理想的催化微環(huán)境。這些結(jié)果共同驗證了該功能肽在界面硅化策略中的關(guān)鍵作用。
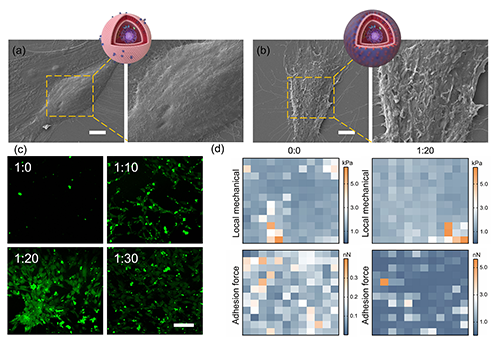
圖3. 界面硅化后MSC表面結(jié)構(gòu)及力學性能變化。a–b)SEM展示了MSC與硅化后細胞表面的結(jié)構(gòu)對比,硅化組(1:20)呈現(xiàn)明顯顆粒沉積;c)共聚焦顯微鏡顯示TEOS沉積隨CPR濃度增強而累積(綠色熒光);d)AFM熱圖揭示硅化處理后細胞局部剛度與黏附力均顯著升高。
為了驗證CPR誘導的“界面硅化”是否真實發(fā)生于細胞表面,研究團隊使用掃描電子顯微鏡(SEM)和原子力顯微鏡(AFM)對MSC進行形貌與力學表征。未處理細胞表面光滑,而硅化處理后細胞表面出現(xiàn)粗糙顆粒狀結(jié)構(gòu),明確提示有無機殼層沉積。AFM測定也顯示,硅化細胞的楊氏模量和黏附力均明顯上升,表明細胞膜結(jié)構(gòu)發(fā)生實質(zhì)性變化。
進一步借助FITC標記的硅前驅(qū)體染色和熒光顯微鏡觀察,不同CPR/TEOS比例組中均觀察到綠色熒光增強,且1:20與1:30組最強,說明在最佳比例下,CPR能顯著促進硅在細胞表面的聚集沉積。
這些結(jié)果不僅直觀展示了“界面硅化”的發(fā)生過程,也揭示其對細胞表面生物力學特性(剛度、附著力等)的影響,為后續(xù)成骨分化的發(fā)生提供了結(jié)構(gòu)和物理基礎。

圖4. 界面硅化顯著促進MSC成骨分化。a–b)ALP染色與活性定量結(jié)果顯示,CPR+TEOS處理組在無誘導因子的BM條件下仍表現(xiàn)出顯著成骨啟動能力;c–d)茜素紅染色及定量結(jié)果揭示礦化水平同步提升;e–f)免疫熒光顯示RUNX2、OPN與OCN表達增強,進一步證實細胞向成骨方向分化。
為了驗證界面硅化策略在生物功能層面的實際成效,研究團隊對MSC成骨分化的全過程進行了系統(tǒng)評價。在未添加任何外源成骨因子的基礎培養(yǎng)條件(Basal Medium, BM)下,CPR+TEOS處理組在第7天即顯示出顯著的堿性磷酸酶(ALP)活性增強,尤其是1:20配比組染色最深,活性提升近兩倍,顯示出優(yōu)異的早期成骨潛能。
在礦化階段,茜素紅染色結(jié)果(第21天和第28天)顯示1:20組鈣鹽沉積最為顯著,呈現(xiàn)大面積紅色結(jié)晶,反映了后期骨基質(zhì)形成能力的增強。進一步的免疫熒光染色與RT-qPCR分析也表明:成骨相關(guān)蛋白(RUNX2、OPN、OCN)表達顯著上調(diào),且分布呈特異性核/胞定位,印證了MSC在界面硅化引導下成功進入成骨分化通路。
值得注意的是,這一效應在無任何成骨培養(yǎng)基的條件下依然穩(wěn)健存在,且多種來源MSC(包括hBMSC和hUMSC)均可復現(xiàn)這一分化趨勢,凸顯其廣泛的適應性與轉(zhuǎn)化潛力。
以上相關(guān)成果以“Interfacial Silicification Efficiently Drives Osteogenic Differentiation of Mesenchymal Stem Cells without Any Exogenous Osteoinductive Factor”為題,發(fā)表于國際權(quán)威期刊《ACS Nano》上。
本研究首創(chuàng)性地提出了一種無需任何外源誘導因子的干細胞成骨分化策略——界面硅化(Interfacial Silicification),通過設計一類功能性兩親肽,在MSC細胞膜表面引導硅前驅(qū)體原位聚合沉積,顯著增強細胞黏附性、機械強度與骨向分化能力。該方法在鼠源、人骨髓及臍帶MSC中均表現(xiàn)出穩(wěn)定誘導效果,具備廣泛的適用性與轉(zhuǎn)化潛力。
相比傳統(tǒng)依賴培養(yǎng)基與生長因子的成骨誘導方式,界面硅化策略不僅降低了操作復雜度與成本,更顯著提升了安全性與可控性,為未來無因子細胞工程與骨組織再生技術(shù)的發(fā)展提供了全新思路。
該論文第一作者為華南理工大學生物科學與工程學院碩士研究生田周萍,通訊作者為華南理工大學生物科學與工程學院朱偉教授和廣東省人民醫(yī)院陳洪林副教授。
該研究得到了國家自然科學基金、廣東省珠江人才計劃、廣東省引進創(chuàng)新創(chuàng)業(yè)團隊計劃、廣東省重點領(lǐng)域研發(fā)計劃等項目的支持。
原文鏈接:https://pubs.acs.org/doi/full/10.1021/acsnano.5c01628
