西南大學Bio-road研發團隊陸飛副教授在國際知名期刊《Carbohydrate Polymers》上發表最新研究成果:Thrombotic microenvironment responsive crosslinking cyclodextrin metal-organic framework nanocarriers for precise targeting and thrombolysis
血栓性疾病造成長期殘疾和死亡,并嚴重威脅公眾健康。大多數溶栓劑,尤其是蛋白質制劑,在循環中的半衰期較短,降低了其溶栓效果。因此,創造一種智能藥物輸送系統,能將藥物精準輸送到血栓部位,并在受控條件下釋放,對于有效溶栓至關重要。
近日,西南大學蠶桑紡織與生物質科學學院Bio-road生物醫用材料研發團隊在《Carbohydrate Polymers》上發表題為“Thrombotic microenvironment responsive crosslinking cyclodextrin metal-organic framework nanocarriers for precise targeting and thrombolysis”的研究論文(10.1016/j.carbpol.2024.122058)。該研究開發了一種獨特的金屬有機框架藥物輸送系統(MCRUA),它對活化血小板具有精準靶向性,并在血栓微環境的刺激下釋放藥物。
在這項研究工作中,作者將尿激酶型纖溶酶原激活劑(uPA)和抗炎藥物阿司匹林(乙酰水楊酸,ASA)加載到具有pH響應性的CaCO3/環糊精交聯金屬有機框架(MC)上,通過分級功能化技術構建精準靶向血小板的雙重給藥溶栓體系(CaCO3/PDA@CD-MOFs-RGD/uPA/ASA)(MCRUA)。該體系可智能靶向活化血小板,在血栓部位特殊的病理微環境中解體釋放uPA和ASA,從而改善血栓內的炎癥環境,增強抗血小板聚集效應,促進協同溶栓治療,并能有效防止血管再栓塞的發生,實現短效溶栓和長效抗凝的作用。
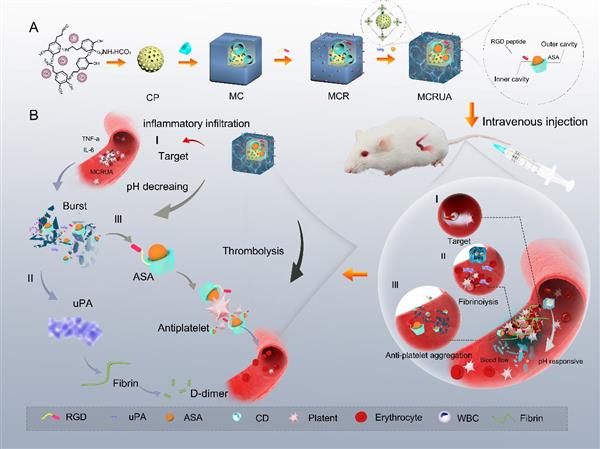
圖1 MCRUA的制備及作用機理
該納米粒子具有完美的正六面體立方核殼結構,中空納米碳酸鈣為核層,環糊精金屬有機框架為殼層。其比表面積高達715.5 m2/g,孔體積為0.2753 cm3/g, 朗繆爾表面積為1142.6852 m2/g,具有非常大的孔隙率。pH為7.4時,納米粒子結構穩定,可通過溶脹的孔隙及靜電相互作用搭載與包封uPA,載藥率可達63.33%,而小分子藥物則能進入環糊精的空腔進行負載;pH為6.5時,納米粒子開始解體,藥物釋放;此外,核磁共振氫譜和紅外光譜測得RGD多肽對其表面的成功修飾,使其具備靶向性能。
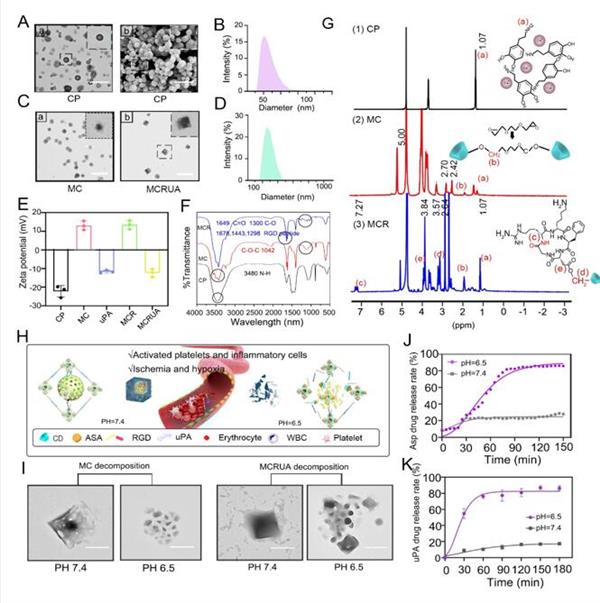
圖2 MCRUA結構表征
該納米體系具有良好的靶向能力,其靶向效率可達96%。圖3A顯示了MCRUA納米粒子在靜息或活化的血小板表面的結合和保留的熒光顯微鏡圖像示例。與靜息血小板相比,活化的血小板具有更大的藍色和綠色熒光強度重疊,這表明MCRUA更容易附著在活化的血小板上。同時藥物負載沒有使靶向率降低,其靶向效率沒有顯著性差異。
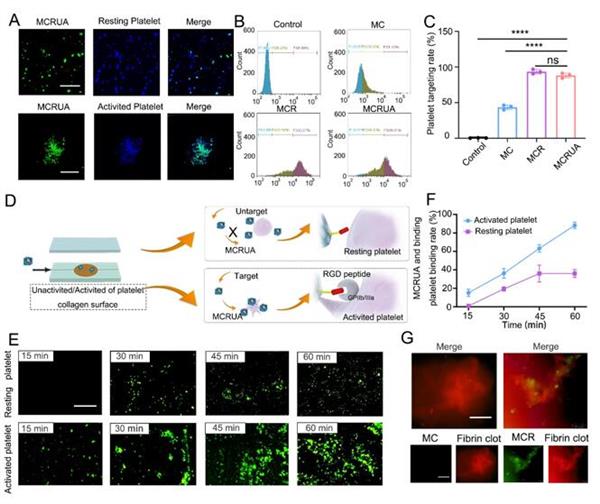
圖3體外靶向性能評估
當血小板和炎癥細胞在血栓形成過程中被激活時,會產生大量的酸性代謝物和氫離子,導致血栓形成環境的酸度增加;缺血和缺氧也導致血栓形成微環境酸度升高。在體外血凝塊溶解實驗、靜態纖維蛋白溶解、動態纖溶實驗和纖維蛋白板都顯示出MCRUA在pH 6.5的條件下顯示出更強的纖溶活性。
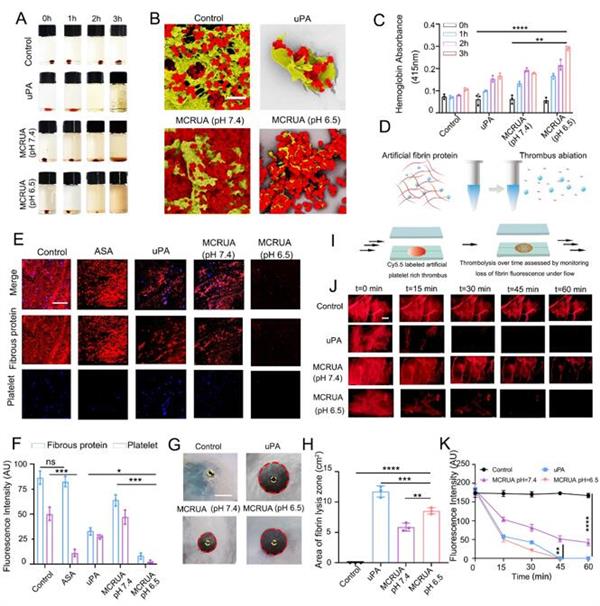
圖4體外溶栓性能評估
MCRUA的溶栓機制是通過靶向激活纖溶系統引起溶栓,阻止血小板聚集。我們通過建立小鼠股靜脈血栓模型評估其溶栓性能.結果表明,MCRUA相比于uPA有更強的溶栓效果,其溶栓效率可達到92.87%。此外,研究發現MCRUA不會引起小鼠sCD40L異常活化而導致出血并發癥,比兩種藥物共同使用時更加具備安全性,因此,該納米遞藥載體良好的藥物遞送能力。

圖5 體內溶栓能力評估
西南大學蠶桑紡織與生物質科學學院2021級碩士研究生袁彩杰為本文第一作者,西南大學陸飛副教授、藍廣芊教授、香港理工大學王文義副研究員為本文的通訊作者。該研究得到了國家自然科學基金、重慶市自然科學基金的資助。
Bio-road研發團隊一直專注于針對創面止血與促愈用材料、體內溶栓藥物載體的研究,近三年課題組成員共主持包括國防項目,國家自然科學基金,重慶市科技攻關項目,重慶市自然科學基金在內的10余項科研項目。在Advanced Functional Materials、Bioactive
Materials、Chemical Engineering Journal等雜志上發表高水平SCI論文50余篇;已申請國家發明專利40項,其中已授權20余項。