課題組關(guān)于“抗腫瘤乏氧的釕(Ⅱ)配位超分子金屬藥物復(fù)合物的設(shè)計(jì)與構(gòu)筑”的研究工作在Advanced Functional Materials上在線發(fā)表
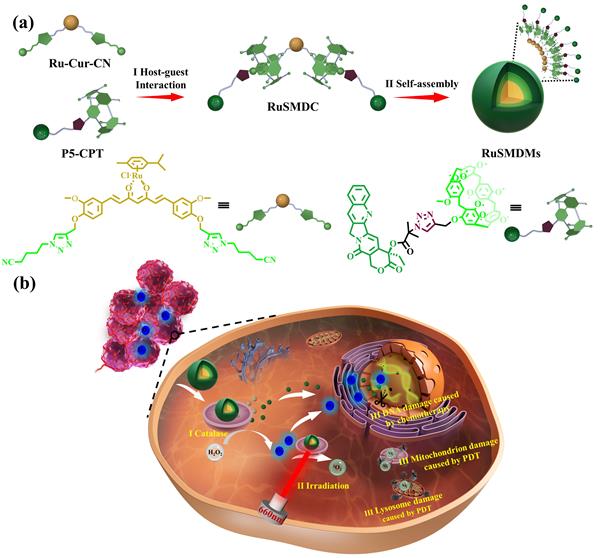
腫瘤組織的快速增殖和腫瘤血管的結(jié)構(gòu)異常,致使腫瘤組織處在高度乏氧的狀態(tài),而這種狀態(tài)極大的限制了具有氧氣依賴的化療、光動(dòng)力和放療等治療效果。目前,主要報(bào)道的同時(shí)將化療藥物與O2催化材料共同包載遞送解決腫瘤乏氧的策略,可能會(huì)導(dǎo)致低的裝載量和可重復(fù)性、以及運(yùn)載過程中藥物泄露等問題,從而極大降低癌細(xì)胞原位O2的產(chǎn)生效率。基于此,本課題組提出一種將有機(jī)金屬配合物與超分子作用相結(jié)合的新策略,實(shí)現(xiàn)癌細(xì)胞內(nèi)高效穩(wěn)定的O2原位自供應(yīng)功能,從而有效解決腫瘤乏氧問題。首先分別設(shè)計(jì)合成了以喜樹堿藥物為基元且末端帶有柱芳烴的主體分子(P5-CPT)和以釕配位的姜黃素藥物為基元且兩端含有氰基的客體分子(Ru-Cur-CN)(Figure 1a)。Ru-Cur-CN中的釕可以催化癌細(xì)胞中過度表達(dá)的H2O2,在癌細(xì)胞中生產(chǎn)大量的O2。其次利用柱芳烴與氰基之間的主客體識(shí)別作用形成釕(Ⅱ)配位的超分子金屬藥物復(fù)合物(Figure 1aⅠ),該復(fù)合物可以在水中自組裝成含釕的超分子球形膠束(Figure 1aⅡ)。最后體內(nèi)體外生物實(shí)驗(yàn)證實(shí),該膠束具有改善腫瘤乏氧微環(huán)境同時(shí)提高化療和光動(dòng)力協(xié)同抗腫瘤效果的作用(Figure 1bⅢ),并且能夠降低藥物對(duì)正常器官的毒副作用。
相關(guān)研究成果已在線發(fā)表于《Advanced Functional Materials》
(論文鏈接:https://onlinelibrary.wiley.com/doi/10.1002/adfm.202105837)。課題組博士生劉程飛和空軍軍醫(yī)大學(xué)李穆瓊為論文的共同第一作者,空軍軍醫(yī)大學(xué)范黎副教授與田威教授為論文的通訊作者。