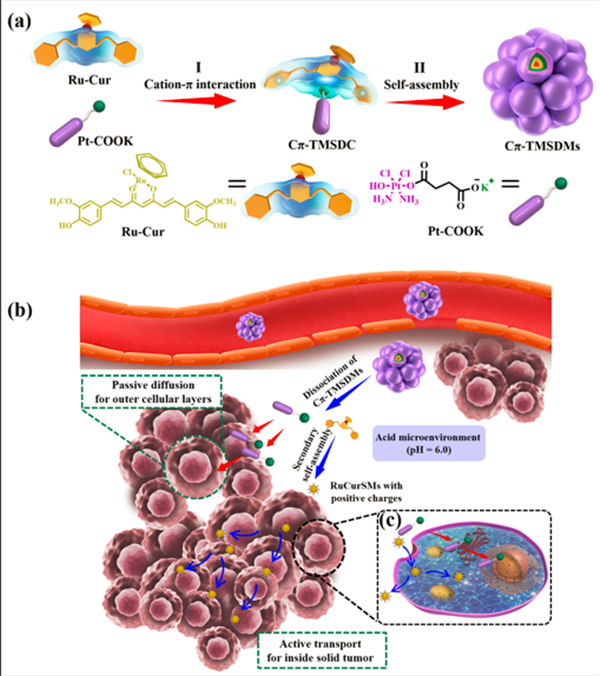
腫瘤特殊的微環境如致密的細胞外基質、較高的間質壓和高的細胞堆積密度等致使藥物很難滲透到腫瘤組織內部,導致腫瘤組織內層部位藥物濃度不足,無法徹底根除全部腫瘤細胞。雖然基于濃度驅動的被動擴散和基于轉胞吞作用的主動滲透在一定程度解決了上述問題,但任何單一的治療策略都不可避免地存在一定的缺陷。基于此,本課題組通過利用陽離子-π的橋連作用構建出一種集被動擴散和主動滲透機制于一體的三金屬超分子藥物復合物(Cπ-TMSDC) (圖1a),該復合物是通過兩種藥物單體間的陽離子-π作用形成。所得的Cπ-TMSDC可以進一步自組裝成基于陽離子-π的三金屬超分子藥物膠束(Cπ-TMSDM)。由于腫瘤組織的酸性微環境,Cπ-TMSDM中陽離子-π作用首先解離,促進Pt-COOK的快速釋放;在濃度梯度驅動的被動擴散影響下,實現順鉑藥物在腫瘤組織外層細胞的快速浸潤(圖1b)。與此同時,釋放的Ru-Cur發生二次自組裝,生成帶有正電荷的小膠束,通過誘導陽離子激活的轉胞吞作用,實現對內層實體腫瘤的主動滲透(圖1b)。以上策略實現了超分子藥物自遞送體系對腫瘤深層的有效滲透,達到了高效腫瘤治療的目的。
相關研究成果已在線發表于《Advanced Functional Materials》
(論文鏈接:https://onlinelibrary.wiley.com/doi/10.1002/adfm.202205043)。
課題組博士研究生劉程飛為論文的第一作者,空軍軍醫大學范黎副教授與田威教授為論文的通訊作者。