張黎明教授課題組在梳形聚合物作為基因和藥物共傳遞載體研究中取得新進展
發布人:材料科學與工程學院 發布日期: 2021-02-23
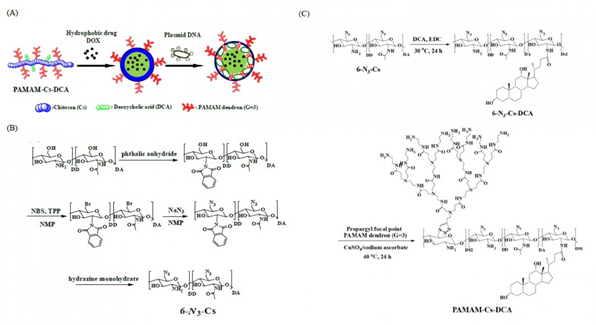
目前����,通過化學療法治療癌癥患者是臨床研究熱點之一�����,但是由于抗癌藥物的副作用和多次藥物后的免疫力現象導致化學療法在臨床醫學上受到極大限制�。這項工作通過點擊化學反應和酰胺化反應�,合成以殼聚糖 (Cs) 為主鏈、聚酰胺-胺樹枝狀分子 (polyamidoamine, PAMAM) 基元和脫氧膽酸 (DCA) 為側鏈的兩親性梳形聚合物 (PAMAM-Cs-DCA)���。HNMR和FTIR表征確定了產物的結構�����。PAMAM-Cs-DCA在水中自組裝形成以PAMAM和Cs為親水外殼��、DCA為疏水內核的納米膠束�,通過熒光光譜�、動態光散射(DLS)和TEM測試,研究了PAMAM-Cs-DCA的膠束化行為�。以阿霉素為模型藥物����,考察了PAMAM-Cs-DCA納米膠束的藥物負載能力和藥物釋放行為���,藥物負載率隨著DCA取代度的增加而增加��,在整個藥物釋放過程中載藥膠束PAMAM-Cs-DCA-DOX的藥物釋放速率都保持緩慢而穩定��,并隨著pH值的降低而變快。凝膠電泳實驗表明當N/P值大于等于1:1時�����,PAMAM-Cs-DCA和負載藥物的PAMAM-Cs-DCA-DOX都能通過親水殼PAMAM基元包裹pDNA��,并完全阻滯pDNA在凝膠電泳中的遷移��。DLS和Zeta電位測試表明,PAMAM-Cs-DCA和PAMAM-Cs-DCA-DOX能和pDNA形成粒徑為200-300 nm的球形復合物�,表面電荷為正值��。MTT測試表明PAMAM-Cs-DCA和PAMAM-Cs-DCA-DOX在293T細胞中具有較低的細胞毒性,遠低于PEI (25 KDa) 的細胞毒性�;負載藥物的PAMAM-Cs-DCA-DOX的細胞毒性稍大于PAMAM-Cs-DCA���。PAMAM-Cs-DCA / pDNA復合物和PAMAM-Cs-DCA-DOX /
pDNA復合物都能有效地將pDNA轉進293T細胞中�����,轉染效率隨N/P值的增加而增加;并且負載阿霉素后����,復合物的轉染效率稍微降低。
近日,相關成果以“Cationic nanoparticles self-assembled
from amphiphilic chitosan derivatives containing poly(amidoamine) dendrons and
deoxycholic acid as a vector for co-delivery of doxorubicin and gene”為題在 Carbohydrate
Polymers (2021���,258,
117706) 上發表。論文的共同第一作者為陳珊珊博士生和鄧俊杰博士,通訊作者為張黎明教授���。
該研究得到國家自然科學基金、廣東省自然科學基金和聚合物復合材料及功能材料教育部重點實驗室的資助與支持。
論文鏈接: https://doi.org/10.1016/j.carbpol.2021.117706
初審:黃艷月
審核:陳永明、黃旭俊
審核發布:李伯軍