趙杰課題組納米抗菌論文"Near-infrared light triggered photodynamic and nitric oxide synergistic antibacterial nanocomposite membrane”高被引
課題組一篇納米抗菌方向的論文(Near-infrared light triggered photodynamic and nitric oxide synergistic antibacterial nanocomposite membrane)高被引。
Jing Sun a,c, Yong Fan b, Wei Ye c, Limei Tian a, Shichao Niu a, Weihua Ming d, Jie Zhao a,*,Luquan Ren a
在此,我們報(bào)道了一種納米復(fù)合聚偏氟乙烯(PVDF)膜,在單次 NIR 激發(fā)下具有 NO 輔助 PDT 抗菌性能,以提高治療效果。歡迎大家繼續(xù)關(guān)注。
文章鏈接:https://www.sciencedirect.com/science/article/pii/S1385894720341668?via%3Dihub
課題組圍繞仿生科學(xué)與工程學(xué)科,致力于仿生設(shè)計(jì)與制造,特別是仿生功能結(jié)構(gòu)設(shè)計(jì)、醫(yī)用抗菌材料等領(lǐng)域,歡迎大家合作交流。
課題組網(wǎng)站:http://m.jrdgc.com/ss/zhaojie1/index.html
文章簡(jiǎn)介
作為一種新興的殺菌策略,光動(dòng)力療法 (PDT) 在對(duì)抗各種病原體感染方面表現(xiàn)出巨大的潛力,但其抗菌效果可能會(huì)受到影響,這通常是由于其對(duì)短波長(zhǎng) (UV/Vis) 光的淺穿透性以及較短的擴(kuò)散長(zhǎng)度和產(chǎn)生的活性氧(ROS)的壽命。在此,我們提出了一種在單次近紅外 (NIR) 光照射下開(kāi)發(fā)具有顯著增強(qiáng)殺菌性能的一氧化氮 (NO) 輔助 PDT 納米復(fù)合膜的方法。初步制備了由上轉(zhuǎn)換納米粒子 (UCNPs) 和卟啉 MOFs (PCN-224) 組成的分層結(jié)構(gòu)納米粒子 (UCNP@PCN)。在摻雜 L-精氨酸 (LA) 后,將納米顆粒摻入聚偏二氟乙烯 (PVDF) 基質(zhì)中,得到電紡納米復(fù)合膜 (UCNP@PCN@LA-PVDF)。 UCNP@PCN@LA-PVDF在近紅外光(980 nm)照射下,可以產(chǎn)生足夠的活性氧,不僅可以作為光動(dòng)力治療的主要?dú)⒕鷦€可以誘導(dǎo)負(fù)載的LA產(chǎn)生一氧化氮,最終實(shí)現(xiàn)一氧化氮輔助的光動(dòng)力殺菌行為。與 ROS 相比,生成的 NO 表現(xiàn)出更大的殺菌面積,證明了在促進(jìn) PDT 抗菌功效方面具有重要的互補(bǔ)優(yōu)勢(shì),如體外和體內(nèi)試驗(yàn)所證明的那樣。這種類型的納米復(fù)合膜可能會(huì)發(fā)現(xiàn)獨(dú)特的生物醫(yī)學(xué)應(yīng)用,其中需要高度增強(qiáng)的 PDT 抗菌效果和 NIR 光的深度穿透。
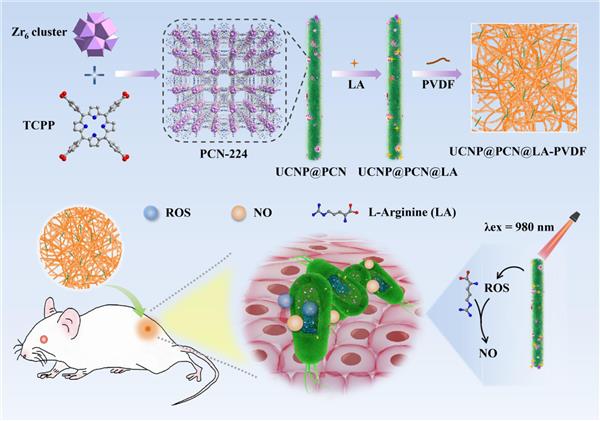 圖Scheme 1. UCNP@PCN@LA-PVDF納米復(fù)合膜的制備及殺菌活性示意圖
圖Scheme 1. UCNP@PCN@LA-PVDF納米復(fù)合膜的制備及殺菌活性示意圖
 圖 1. (A, B) UCNPs 和 UCNP@PCN 的 SEM 照片。 (C, D) UCNP@PCN@LA-PVDF 的 TEM 和 SEM 圖像。 (E-G) UCNP@PCN@LA-PVDF 的元素映射(Yb 為綠色,Zr 為紫色,N 為藍(lán)色)。 (H) UCNP@PCN@LA-PVDF 的能量色散光譜儀 (EDS) 光譜。 (有關(guān)此圖例中顏色參考的解釋,請(qǐng)讀者參考本文的網(wǎng)絡(luò)版本。)
圖 1. (A, B) UCNPs 和 UCNP@PCN 的 SEM 照片。 (C, D) UCNP@PCN@LA-PVDF 的 TEM 和 SEM 圖像。 (E-G) UCNP@PCN@LA-PVDF 的元素映射(Yb 為綠色,Zr 為紫色,N 為藍(lán)色)。 (H) UCNP@PCN@LA-PVDF 的能量色散光譜儀 (EDS) 光譜。 (有關(guān)此圖例中顏色參考的解釋,請(qǐng)讀者參考本文的網(wǎng)絡(luò)版本。)
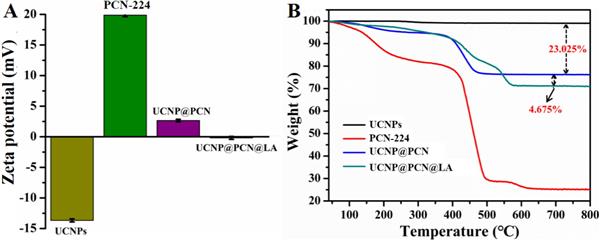 圖 2. (A, B) UCNPs、PCN-224、UCNP@PCN 和 UCNP@PCN@LA 的 Zeta 電位和 TGA 曲線
圖 2. (A, B) UCNPs、PCN-224、UCNP@PCN 和 UCNP@PCN@LA 的 Zeta 電位和 TGA 曲線
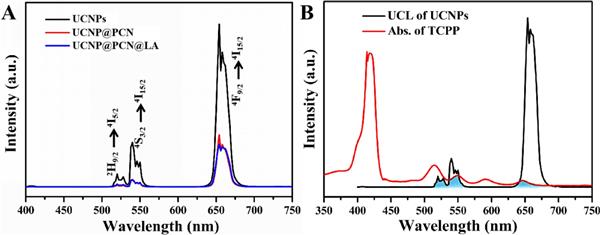 圖 3. (A) UCNPs、UCNP@PCN 和 UCNP@PCN@LA 納米粒子在 980 nm 激光激發(fā)下的上轉(zhuǎn)換發(fā)光 (UCL) 光譜, (B) UCNPs 的 UCL 光譜和 TCPP 的吸收光譜,這兩個(gè)光譜的重疊顯示為藍(lán)色。 (有關(guān)此圖例中顏色參考的解釋,請(qǐng)讀者參考本文的網(wǎng)絡(luò)版本。)
圖 3. (A) UCNPs、UCNP@PCN 和 UCNP@PCN@LA 納米粒子在 980 nm 激光激發(fā)下的上轉(zhuǎn)換發(fā)光 (UCL) 光譜, (B) UCNPs 的 UCL 光譜和 TCPP 的吸收光譜,這兩個(gè)光譜的重疊顯示為藍(lán)色。 (有關(guān)此圖例中顏色參考的解釋,請(qǐng)讀者參考本文的網(wǎng)絡(luò)版本。)
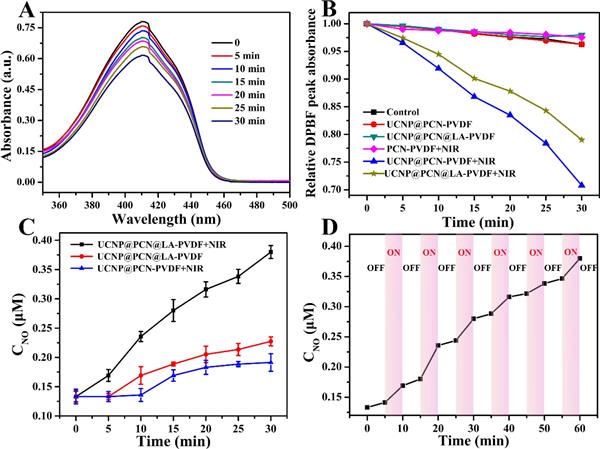 圖 4. (A) 近紅外激光照射(功率 = 0.5 W)后 UCNP@PCN@LA-PVDF 中 DPBF 吸收光譜的變化。 (B) DPBF 在 410 nm 處的吸收強(qiáng)度作為不同樣品的時(shí)間函數(shù)。 (C) 不同組的 NO 釋放:UCNP@PCN@LA-PVDF + NIR、UCNP@PCN@LA-PVDF 和 UCNP@PCN-PVDF + NIR。 (D) UCNP@PCN@LA-PVDF 在重復(fù)開(kāi)/關(guān) NIR 照射下沒(méi)有釋放。
圖 4. (A) 近紅外激光照射(功率 = 0.5 W)后 UCNP@PCN@LA-PVDF 中 DPBF 吸收光譜的變化。 (B) DPBF 在 410 nm 處的吸收強(qiáng)度作為不同樣品的時(shí)間函數(shù)。 (C) 不同組的 NO 釋放:UCNP@PCN@LA-PVDF + NIR、UCNP@PCN@LA-PVDF 和 UCNP@PCN-PVDF + NIR。 (D) UCNP@PCN@LA-PVDF 在重復(fù)開(kāi)/關(guān) NIR 照射下沒(méi)有釋放。
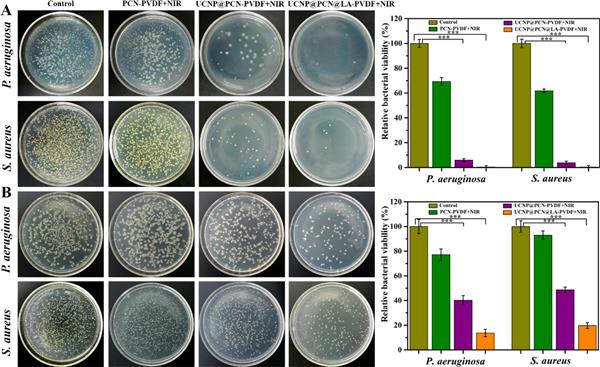 圖 5. (A) 不同組銅綠假單胞菌和金黃色葡萄球菌的表面(接觸模型)抗菌活性。 (B) 不同組中銅綠假單胞菌和金黃色葡萄球菌的空間(附近模型)抗菌活性。
圖 5. (A) 不同組銅綠假單胞菌和金黃色葡萄球菌的表面(接觸模型)抗菌活性。 (B) 不同組中銅綠假單胞菌和金黃色葡萄球菌的空間(附近模型)抗菌活性。
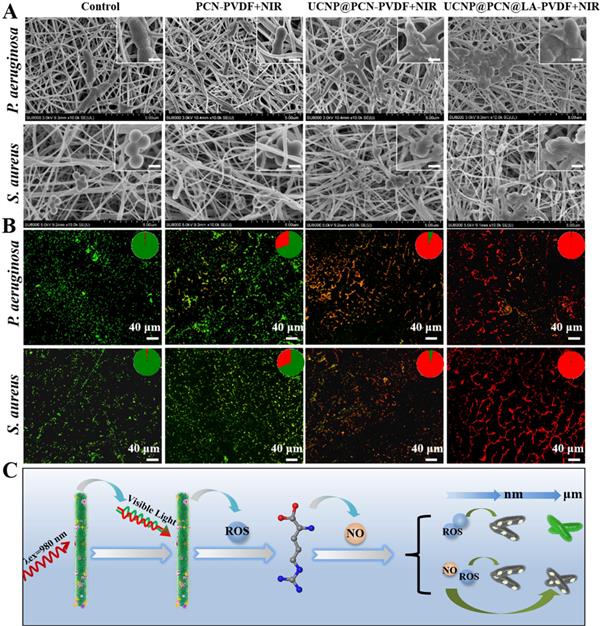 圖 6. (A) 附著在不同膜上的銅綠假單胞菌和金黃色葡萄球菌的 SEM 圖像,經(jīng)過(guò)/不經(jīng)過(guò) NIR 處理(插圖比例尺為 500 nm)。 (B) 附著在不同膜處理的 PET 薄膜上的銅綠假單胞菌和金黃色葡萄球菌的 CLSM 圖像。 (C) NO輔助PDT抗菌策略的說(shuō)明機(jī)制。
圖 6. (A) 附著在不同膜上的銅綠假單胞菌和金黃色葡萄球菌的 SEM 圖像,經(jīng)過(guò)/不經(jīng)過(guò) NIR 處理(插圖比例尺為 500 nm)。 (B) 附著在不同膜處理的 PET 薄膜上的銅綠假單胞菌和金黃色葡萄球菌的 CLSM 圖像。 (C) NO輔助PDT抗菌策略的說(shuō)明機(jī)制。
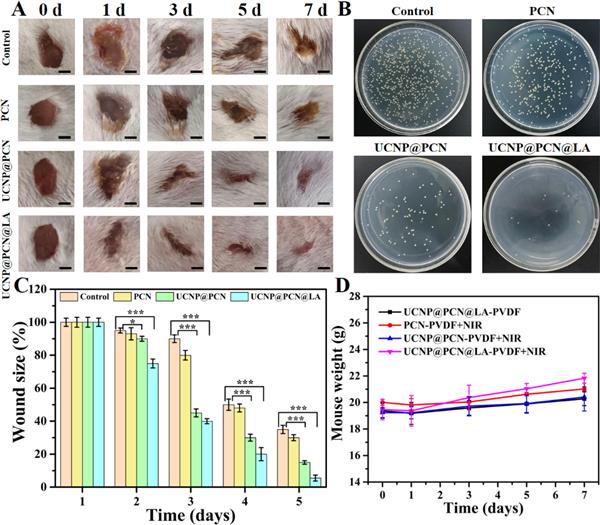
圖 7. (A) 不同處理 0、1、3、5 和 7 天后感染傷口的代表性照片(比例尺為 2.5 mm)。 (B) 在第 2 天從小鼠傷口中分離出的細(xì)菌。(C) 隨著時(shí)間的推移評(píng)估相對(duì)傷口面積。 (D) 不同處理 0、1、3、5 和 7 天后受感染小鼠的體重變化

圖 8 不同組治療后(A)H&E和(B)Masson''s trichome染色皮膚組織的顯微照片,藍(lán)色箭頭表示毛囊,黃色箭頭表示炎癥細(xì)胞,紅色箭頭表示新形成的血管. (有關(guān)此圖例中顏色參考的解釋,請(qǐng)讀者參考本文的網(wǎng)絡(luò)版本。)
總之,我們展示了一種 NIR 光誘導(dǎo)的納米復(fù)合膜,該膜具有來(lái)自 PDT 和 NO 的高效協(xié)同抗菌作用。在一步近紅外光照射下,所得的 UCNP@PCN@LA-PVDF 產(chǎn)生足夠的 ROS,既可以作為 PDT 中的殺菌劑,又可以通過(guò)與膜中的 LA 反應(yīng)觸發(fā) NO 的產(chǎn)生。與僅在 NIR 照射下產(chǎn)生 ROS 的 UCNP@PCN-PVDF 相比,UCNP@PCN@LA-PVDF 顯示出顯著增強(qiáng)的殺菌性能。其機(jī)制主要取決于生成的 NO 具有比 ROS 更大的擴(kuò)散長(zhǎng)度,如“接觸模型”和“附近模型”抗菌測(cè)試所示。此外,這種 NO 輔助的 PDT 膜可以抵抗炎癥并加速傷口愈合,這是由于 NO 具有顯著的協(xié)同抗菌性能和促進(jìn)角質(zhì)形成細(xì)胞增殖和成纖維細(xì)胞遷移的能力。細(xì)胞毒性測(cè)定表明,納米復(fù)合膜對(duì)哺乳動(dòng)物細(xì)胞具有高細(xì)胞相容性。總體而言,這種 NIR 誘導(dǎo)的 NO 輔助 PDT 納米復(fù)合膜可以作為安全可控的生物醫(yī)學(xué)平臺(tái),用于對(duì)抗各種病原菌污染和傷口感染。