復合水凝膠通過引入多元組分(如聚合物、金屬離子、納米材料)有效克服了單組分水凝膠機械強度不足和穩定性差等局限,顯著提升了其結構強度、多功能性和響應性。本文系統綜述了復合水凝膠的發展路徑,涵蓋聚合物基質選擇、制備機制、功能調控策略及其在生物醫用領域的應用前景,并指出未來需突破機械性能動態匹配和臨床轉化標準化等關鍵挑戰。
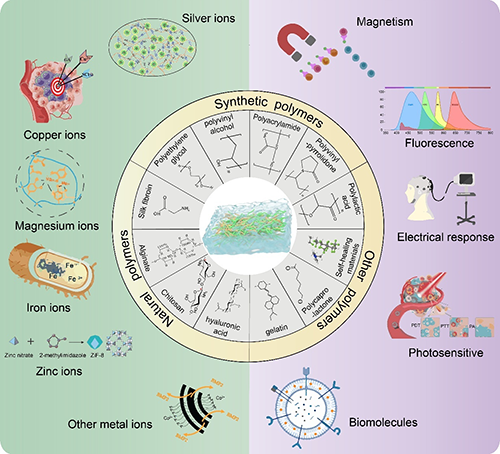
水凝膠作為一類高度親水的三維聚合物網絡材料,因其優異的生物相容性、可調節性及刺激響應性,近年來在組織工程、藥物遞送、智能生物電子等領域得到廣泛關注。然而,單組分水凝膠常存在機械強度不足、穩定性差等問題,限制了其在復雜環境中的應用。為解決這些挑戰,復合水凝膠應運而生,其通過引入多種聚合物、金屬離子以及功能性納米材料,賦予材料更優的結構強度、多功能性及響應性。基于此,重慶醫科大學毛翔團隊聯合哈爾濱工業大學賀良燦團隊在《Small》期刊(IF=12.1)發表了題為《Innovations and Applications of Composite Hydrogels: from Polymer-Based Systems to Metal-Ion-Doped and Functional Nanomaterial-Enhanced Architectures》的綜述文章。該文章系統總結了當前復合水凝膠的研究進展、構建策略及其在多學科交叉應用中的創新成果。文章指出,未來復合水凝膠將朝著智能化、多功能化方向發展,并加速臨床轉化進程,為精準醫療和再生醫學提供關鍵材料支撐。作者們系統闡述了復合水凝膠的發展路徑:從基于天然與合成高分子基質的體系,到摻雜金屬離子及功能納米材料的增強型結構水凝膠,深入探討了其制備機制、功能調控手段以及在多種生物醫學領域的應用前景。同時,文章也明確指出,未來該領域需著力突破機械性能動態匹配和臨床轉化標準化等核心挑戰。
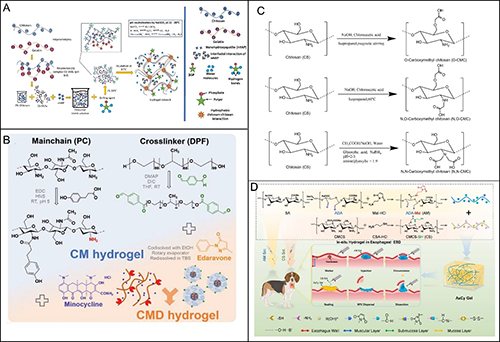
殼聚糖水凝膠的制備和應用。
隨著水凝膠材料在組織工程、藥物遞送與再生醫學等領域的廣泛應用,其基底材料的選擇愈發成為決定水凝膠性能與適應性的關鍵因素。近年來,天然高分子水凝膠因其生物相容性優異、結構多樣、可降解性強,逐漸成為復合水凝膠體系設計的核心構建模塊。該團隊重點聚焦兩類天然聚合物水凝膠:多糖基水凝膠與蛋白質基水凝膠。這兩類材料不僅在結構上具備良好的親水性與可加工性,更在生理環境中表現出優異的生物功能性,廣泛用于細胞培養、傷口愈合、軟組織替代與智能藥物遞送等多種生物醫學場景。此外,現代制備技術,如酶介導交聯、生物基熒光標記與納米顆粒復合等,賦予多糖類水凝膠更多“智能屬性”,如可注射性、自愈性、可視化追蹤等,為其邁入臨床轉化打下基礎。
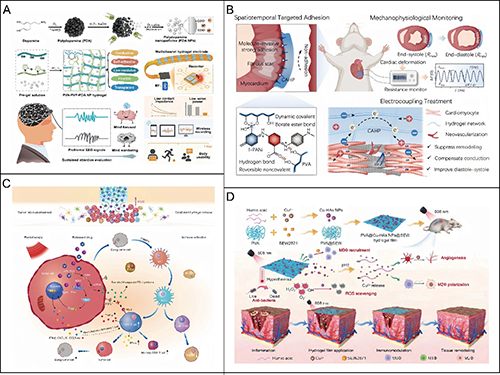
聚乙烯醇基水凝膠的制備和應用。
在復合水凝膠構建策略中,金屬離子與功能納米材料的引入已成為突破傳統水凝膠性能瓶頸的關鍵手段。它們不僅在微觀結構上賦予材料更強的穩定性與環境響應性,更在宏觀層面大幅提升生物功能,推動水凝膠在組織修復、靶向治療與智能診療等前沿領域的廣泛應用。金屬離子廣泛存在于生理環境中,天然參與細胞復制、蛋白合成、信號轉導等重要過程。將其引入水凝膠體系,不僅能夠提供基本的物理交聯位點,還能賦予水凝膠生物活性、導電性、機械強度等多維功能。目前常用的金屬離子種類涵蓋Fe2?、Fe3?、Cu2?、Eu3?、Ag?、Zn2?、Mg2?、Ca2?等,功能各異,優勢顯著。其中,Ag?因其卓越的抗菌能力,在感染性慢性傷口治療中被廣泛應用;Cu2?與Eu3?則通過促血管生成顯著加快組織修復進程;Zn2?、Mg2?和Ca2?在骨組織工程中具有良好礦化誘導能力,能夠調控巨噬細胞極化促進骨再生。而Fe2?與Fe3?之間的可逆轉化機制,使其兼具光熱效應與芬頓反應能力,在腫瘤治療與抗菌清除中展現出獨特優勢。此外,稀土元素Eu3?在熒光成像與抗菌方面也展現了良好應用前景。通過調控金屬離子的種類、濃度與交聯方式,不僅可實現水凝膠物理性能的精細調控,還能建立起智能響應性系統,在靶向釋放、局部刺激、環境適應等功能上發揮關鍵作用。然而,目前該方向仍面臨多重挑戰,例如金屬離子的長期生物安全性、可控釋放機制、生物互作復雜性及免疫應答影響尚不明晰,制約了其臨床應用推廣,亟待深入機理研究與多中心評價體系建立。
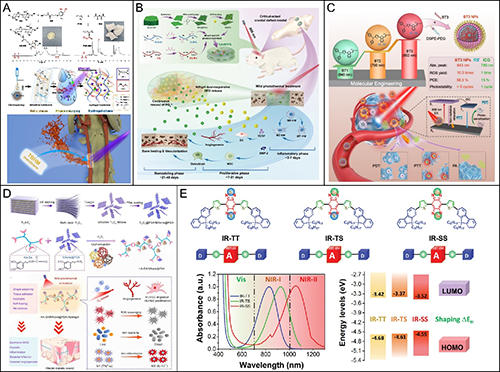
光敏納米水凝膠的制備和應用。
相較于傳統微米尺度增強填料,納米材料因其優異的比表面積效應與界面活性,在水凝膠增強中表現更為顯著。納米水凝膠作為一個蓬勃發展的子領域,充分利用納米材料與高分子網絡的協同效應,實現了水凝膠在結構、功能與應用維度上的全面提升。例如,磁性納米水凝膠通過引入Fe?O?等磁性納米顆粒,使其具備對外磁場的響應性,實現藥物靶向釋放、磁引導細胞排列及三維結構動態調控,極大拓寬了其在精準醫療與組織工程領域的應用邊界。熒光納米水凝膠則通過摻雜量子點或稀土摻雜納米顆粒,賦予水凝膠成像與追蹤功能,提升藥物釋放過程的可視化監控能力,為智能診療一體化提供基礎支撐。在神經組織工程與電子醫學交叉領域,導電性納米水凝膠成為重要材料類型。其通過摻雜碳納米管、MXene、PEDOT等導電納米材料,在維持水凝膠柔性與生物相容性的同時,實現電刺激響應性,可促進神經元黏附與軸突再生,構建新型神經修復微環境。此外,光敏納米水凝膠因摻入了特定光敏分子(如伊紅、聚吡咯、光敏MOF等),可在特定波長激光照射下實現局部升溫、藥物釋放或細胞響應,廣泛用于光控治療、細胞誘導與創面重建;生物活性納米水凝膠則借助酶、蛋白質、寡肽等構建仿生界面,精準模擬細胞外基質微環境,促進干細胞定向分化與組織重建,特別適用于心肌、軟骨等高仿生修復場景。
綜上所述,復合水凝膠作為新一代智能材料,通過整合金屬離子、納米材料及生物活性分子,在力學性能、刺激響應性和生物功能性上實現協同增強,廣泛應用于藥物遞送、組織工程和智能感應。盡管在刺激響應精度、結構穩定性(如力學強度不足、降解控制難)及臨床轉化方面仍存挑戰,但隨著材料科學與生物技術的發展,其在個性化醫療、可穿戴設備及環境友好材料領域將持續突破。集自愈、抗菌、感應于一體的智能復合水凝膠,將成為推動醫療與環境技術革新的重要力量。
原文鏈接:https://doi.org/10.1002/smll.202503147
- 福州大學呂曉林/吳明懋 Adv. Mater.:超分子復合水凝膠鎖定陰離子提高鋅離子電池循環壽命 2025-04-21
- 浙江省人民醫院孫燚團隊、福州大學張進教授團隊《ACS Nano》:仿生CAT納米酶修飾的光增強復合水凝膠用于級聯調控骨再生 2025-04-12
- 四川大學鄧怡團隊《ACS Nano》:多功能納米生物異質結復合水凝膠敷料 - 用于傷口細菌生物膜感染的診療一體化新策略 2025-03-15
- 蘇科大葉常青教授團隊連發 AFM/Small: 液態金屬-聚合物體系的開發和應用方面取得系列進展 2025-01-22
- 蘇州大學張偉教授團隊 Angew:消旋聚合物體系中全局域手性的動態切換 2024-11-13
- 重慶理工大學楊朝龍課題組《Adv. Funct. Mater.》: 基于柔性交聯聚合物體系的超低溫可視化檢測 2024-10-29
