結核病(Tuberculosis,TB)是由結核分枝桿菌(Mycobacterium tuberculosis,M.tb)感染引發(fā)的慢性傳染性疾病,是單病原體致死人數(shù)最多的傳染病(高于艾滋病),嚴重威脅人類健康。TB患者咳出的M.tb被健康人吸入后,首先被肺泡巨噬細胞吞噬并將M.tb運送到深部肺組織;被感染的肺泡巨噬細胞會招募大量免疫細胞到達感染部位,形成結核結節(jié)(Granuloma)。結核結節(jié)是TB特征性結構,由大量巨噬細胞緊密排列而成,其中心為“中央壞死區(qū)”,內(nèi)含大量M.tb和與之對抗而死亡的巨噬細胞碎片。結核結節(jié)的致密結構能夠有效隔離M.tb防止感染擴散。但是,當人體免疫力下降時,結核結節(jié)內(nèi)的M.tb將大量活化和增殖,引發(fā)活動性結核。更重要的是,結核結節(jié)的致密結構嚴重限制了抗生素進入,致使臨床上常規(guī)的多藥聯(lián)合治療方案療效差、療程長、毒副作用大,從而導致患者依從性差及結核病的遷延不愈。因此,構建靶向結核結節(jié)的診療系統(tǒng)有望克服傳統(tǒng)抗生素療法的缺陷,成為結核病的新型診療方案。
中山大學附屬第五醫(yī)院廖玉輝、黃曦、單鴻教授團隊聯(lián)合香港科技大學唐本忠院士、趙征博士,開發(fā)了集新型聚集發(fā)光(AIE)材料、抗結核一線藥物利福平(RIF)、雙親性膠束分子(DSPE-PEG2000)為一體的多功能納米膠束。此納米膠束表面的PEG鏈能夠延長體內(nèi)長循環(huán),AIE材料發(fā)射強烈熒光實現(xiàn)結核結節(jié)的體內(nèi)成像和追蹤,AIE材料在激發(fā)光作用下產(chǎn)生大量ROS實現(xiàn)結核菌的光動力殺傷,納米膠束包裹的RIF實現(xiàn)結核病的靶向協(xié)同化療,最終實現(xiàn)結核病的精準診療(圖1)

圖1. 結核病精準診療原理圖。Step 1:bottom-up方法合成多功能納米膠束TTD+RIF NPs;Step 2:TTD+RIF NPs通過長循環(huán)和EPR效應實現(xiàn)結核結節(jié)靶向成像和追蹤;Step 3:TTD+RIF NPs實現(xiàn)結核菌的光動力殺傷合并藥物治療。
該團隊首先系統(tǒng)合成了新型AIE材料TTD(圖2A),發(fā)現(xiàn)其具有發(fā)射強烈紅色熒光特性(圖2B)、聚集發(fā)光特性(圖2C)和強烈的ROS產(chǎn)生特性。通過bottom-up方式合成TTD+RIF NPs后,可以得到粒徑為~120 nm的球型納米膠束TTD+RIF NPs(圖2D),此NPs除了具備TTD的基本特性之外(圖2E),還包裹了抗結核一線藥物RIF(圖F),從而實現(xiàn)結核菌的協(xié)同化療。

圖2. 新型AIE材料TTD和多功能納米膠束TTD+RIF NPs的合成和表征。
靜脈注射此多功能納米膠束TTD+RIF NPs到兩種結節(jié)動物模型(圖3)體內(nèi)后,TTD+RIF NPs會借助其表面的PEG鏈逃避吞噬細胞的清除而實現(xiàn)體內(nèi)長循環(huán)。通過EPR效應,TTD+RIF NPs靶向結節(jié),實現(xiàn)結節(jié)的靶向成像(圖4A,4C),并長期滯留結節(jié)部位,實現(xiàn)單個結節(jié)的長期靶向追蹤(圖4B)。

圖3. (A-C) 海分枝桿菌感染所致斑馬魚神經(jīng)管結節(jié)模型構建;(D-H) 海分枝桿菌感染所致小鼠尾部結節(jié)模型構建

圖4. (A) TTD+RIF NPs實現(xiàn)斑馬魚結節(jié)的靶向成像;(B) TTD+RIF NPs實現(xiàn)斑馬魚單個結節(jié)的靶向追蹤;(A) TTD+RIF NPs實現(xiàn)小鼠尾部結節(jié)靶向成像。
對斑馬魚局部結節(jié)進行光照,相比于單純RIF治療組和PBS組,TTD+RIF NPs能夠顯著殺傷斑馬魚結節(jié)內(nèi)部的海分枝桿菌(圖5A,5B),斑馬魚生存率大大提高(圖5C)。更重要的是,TTD+RIF NPs還能夠顯著殺傷對RIF完全耐藥的耐藥性結核桿菌(圖5D,5F),預示著TTD+RIF NPs對治療臨床耐藥性結核的巨大潛力。綜上,基于聚集發(fā)光的多功能納米膠束TTD+RIF NPs的納米載藥體系可以實現(xiàn)單個結核結節(jié)的靶向成像和追蹤,能夠顯著殺傷結節(jié)內(nèi)部的病原菌并對臨床耐藥菌有殺傷效果,為實現(xiàn)結核病精準診療提供新的思路,具有巨大的臨床應用潛力。
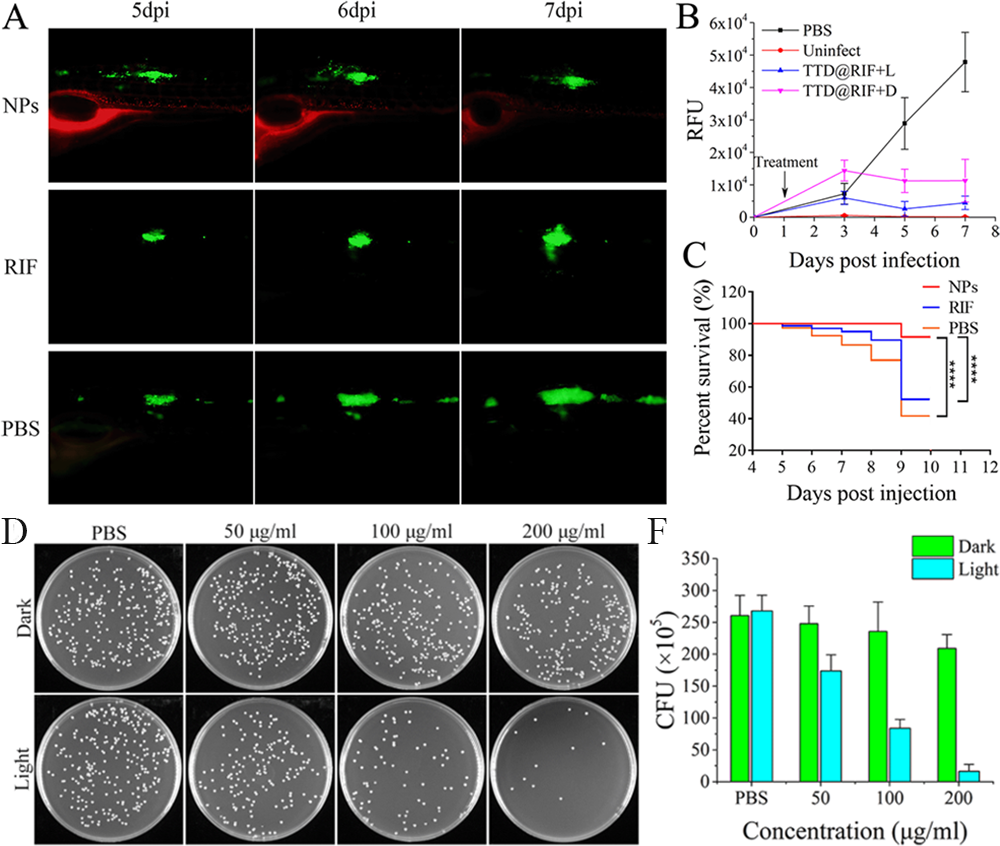
圖5. (A-C) TTD+RIF NPs實現(xiàn)斑馬魚結節(jié)部位海分枝桿菌的光動力殺傷合并藥物治療;(D-F) TTD+RIF NPs實現(xiàn)耐藥結核菌的有效殺傷。
論文信息:Yuhui Liao?, Bin Li?, Zheng Zhao?, Yu Fu, Qingqin Tan, Xingyu Li, Wei Wang, Jialing Yin, Hong Shan*, Ben Zhong Tang*, Xi Huang*. Targeted Theranostics for Tuberculosis: A Rifampicin-Loaded Aggregation-Induced Emission Carrier for Granulomas-Tracking and Anti-Infection. ACS Nano. 10.1021/acsnano.0c00586 (SCI indexed, IF= 13.903; 工程技術一區(qū))
論文鏈接:https://doi.org/10.1021/acsnano.0c00586
- 香港中文大學(深圳)唐本忠院士/趙征教授團隊《ACS Nano》:細胞膜靶向的聚集誘導發(fā)光分子用于神經(jīng)追蹤和損傷的可視化 2025-01-21
- 香港中文大學(深圳)唐本忠院士與趙征教授團隊《ACS Nano》綜述:聚集誘導發(fā)光材料實現(xiàn)高分辨生物成像 2025-01-07
- 港中深唐本忠院士/北理工黎朝 AM:基于AIE活性納米復合水凝膠的可穿戴交互式信息-傳感材料 2024-03-23
- 青島大學魏登帥、孫勇等 ACS Nano綜述:基于刺激響應性聚合物的納米體系在癌癥診療中的研究進展 2023-12-06
- 四川大學王云兵教授團隊 Biomaterials:具有免疫逃逸功能的納米載藥涂層 2023-09-16
- 中科院高能所胡毅研究員和陳俊副研究員課題組在發(fā)展新型刺激響應性細胞靶向策略方面取得進展 2019-05-28
- 法國CNRS彭玲團隊 PNAS:納米藥物遞送系統(tǒng) - 自組裝樹形分子超分子納米膠束通過劫持細胞外囊泡的方式深層遞送抗癌藥物 2023-06-07
