在再生醫(yī)學(xué)、器官芯片和藥物篩選等交叉領(lǐng)域中,紛繁復(fù)雜的場景對血管網(wǎng)絡(luò)構(gòu)建技術(shù)提出了越來越高的“適應(yīng)性(adaptability)”要求:不僅要精準(zhǔn)還原目標(biāo)結(jié)構(gòu)與尺寸,還需兼容多種材料體系以實(shí)現(xiàn)功能適配,以此來滿足不同的應(yīng)用目的。目前,犧牲模板法(sacrificial templating)因其工藝簡便、適配性廣,成為構(gòu)建通道網(wǎng)絡(luò)的常用策略。該方法通過預(yù)先打印可移除的犧牲材料(sacrificial materials),將其嵌入至基材中,待基材固化后溶解模板,從而形成通道結(jié)構(gòu)。然而,現(xiàn)有犧牲材料在實(shí)際應(yīng)用中普遍存在三類問題:1)打印成型性有待改善,難以構(gòu)建多級分支結(jié)構(gòu)(如明膠);2)溶解時易發(fā)生溶蝕變形,導(dǎo)致通道保真度下降,影響尺寸還原(如PVA、Pluronic F-127);3)材料兼容性不佳,只能選擇單一的親水或疏水性基材,或依賴特定的打印體系(如嵌入式打印)。
澳門大學(xué)王春明教授團(tuán)隊(duì)提出“通過非溶劑(nonsolvent)控制氫鍵取向來穩(wěn)定犧牲材料界面”的策略解決。犧牲材料在嵌入過程中界面不穩(wěn)定是限制適應(yīng)性的底層原因,界面不穩(wěn)定將導(dǎo)致基材中的溶劑在固化前快速滲入模板內(nèi)部,使其在被移除前出現(xiàn)不可控的溶脹(親水性基材)或脫水變形(疏水性基材),最終破壞預(yù)設(shè)的通道結(jié)構(gòu)。非溶劑是指可與水互溶但無法溶解犧牲材料的有機(jī)試劑。此前,團(tuán)隊(duì)已在相關(guān)研究中提出“非溶劑淬火(nonsolvent quenching, NSQ)”打印方法(Adv Sci 2022, 2203236),通過誘導(dǎo)材料表面快速硬化,在界面形成致密保護(hù)層,有效提升結(jié)構(gòu)保真度。在本研究中,團(tuán)隊(duì)進(jìn)一步推測該過程可驅(qū)動材料表面氫鍵由“指向外部溶劑”轉(zhuǎn)變?yōu)?/span>“材料內(nèi)部自連”,進(jìn)而建立起抵御外部侵蝕的穩(wěn)定屏障,從而抑制犧牲模板在嵌入基材后的膨脹與變形,基于此提出氫鍵重定向策略(Hydrogen Bond Re-Orientation, HyBRO),通過將氫鍵從“向外”轉(zhuǎn)為“向內(nèi)”,實(shí)現(xiàn)對界面的有效保護(hù)(圖1)。

圖1. 傳統(tǒng)策略 vs HyBRO:通過氫鍵定向調(diào)控,實(shí)現(xiàn)高適應(yīng)性的血管網(wǎng)絡(luò)構(gòu)建工藝
為驗(yàn)證HyBRO策略的分子機(jī)制,課題組以模式分子葡甘聚糖(GM)為模型,系統(tǒng)研究了非溶劑DMF在淬火過程中的氫鍵重定向效應(yīng)。實(shí)驗(yàn)發(fā)現(xiàn),在加入氫鍵干擾劑尿素后,相分離顯著延遲,表明氫鍵作用是驅(qū)動淬火的關(guān)鍵。SAXS結(jié)果顯示,NSQ處理將促使GM形成更致密、穩(wěn)定的聚集體;ATR-FTIR分析進(jìn)一步確認(rèn),淬火顯著提升了GM鏈間氫鍵比例,同時抑制了GM與外部溶劑(水)之間的氫鍵形成,驗(yàn)證了氫鍵從“對外”向“內(nèi)聚”的定向轉(zhuǎn)變。
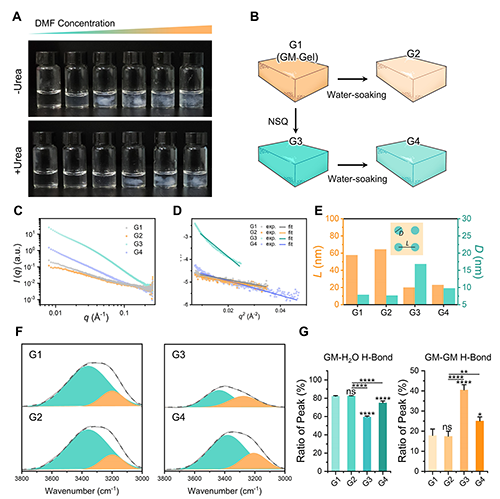
圖2. NSQ實(shí)現(xiàn)GM氫鍵重定向
在明確這一機(jī)制后,團(tuán)隊(duì)進(jìn)一步驗(yàn)證了HyBRO策略的實(shí)際效果。實(shí)驗(yàn)表明,未經(jīng)處理的塊狀凝膠在水中易發(fā)生劇烈溶脹,溶脹變化超過320%;而經(jīng)HyBRO處理后,溶脹率控制在約131%,結(jié)構(gòu)穩(wěn)定性顯著提升。更重要的是,HyBRO模板生成的通道尺寸與設(shè)計(jì)值高度一致,誤差控制在±10%以內(nèi),有效保障了通道結(jié)構(gòu)的保真度與一致性。借助這一策略,團(tuán)隊(duì)在明膠和海藻酸鈉體系中成功構(gòu)建出三次分叉的層級血管網(wǎng)絡(luò),通道直徑覆蓋40~400 μm,精準(zhǔn)實(shí)現(xiàn)從微血管到小動脈的十倍尺度跨越,充分展示了HyBRO在通道精度、尺寸可控性和復(fù)雜結(jié)構(gòu)再現(xiàn)方面的綜合優(yōu)勢。

圖3. HyBRO顯著抑制溶脹,實(shí)現(xiàn)高保真度通道構(gòu)建
鑒于傳統(tǒng)方法在親疏水材料間的選擇受限,課題組進(jìn)一步將HyBRO策略擴(kuò)展應(yīng)用于多種代表性材料,以驗(yàn)證其廣譜兼容能力。結(jié)果顯示,HyBRO可在海藻酸鈉、明膠、瓊脂糖和GelMA等常見親水性基材中穩(wěn)定構(gòu)建通道結(jié)構(gòu);同時,在乙酰化葡甘聚糖、聚己內(nèi)酯和聚乳酸-羥基乙酸共聚物等疏水性基材中同樣表現(xiàn)出良好成型能力。此外,HyBRO不僅適用于GM類多糖材料,對于傳統(tǒng)的PVA模板也能顯著提升其結(jié)構(gòu)保真度,進(jìn)一步印證了該策略在不同材料平臺下的適用性。

圖4. HyBRO可與多種親/疏水基材兼容
HyBRO策略不僅具有優(yōu)越的適應(yīng)性,還能支持內(nèi)皮細(xì)胞生長和功能表達(dá)。實(shí)驗(yàn)表明,內(nèi)皮細(xì)胞在通道內(nèi)可逐步建立穩(wěn)定的胞間連接,顯著抑制物質(zhì)的滲透,展現(xiàn)出典型的血管屏障功能。更重要的是,該通道系統(tǒng)能夠模擬生理剪切應(yīng)力,誘導(dǎo)內(nèi)皮細(xì)胞通過TRPV4感知流體刺激,激活鈣信號通路并促進(jìn)一氧化氮釋放,呈現(xiàn)出與真實(shí)血管相似的力學(xué)應(yīng)答與生理調(diào)控特性。這一系列結(jié)果表明,HyBRO不僅可實(shí)現(xiàn)結(jié)構(gòu)精細(xì)、尺寸可控的血管網(wǎng)絡(luò)構(gòu)建,更具備重建具功能活性血管系統(tǒng)的潛力。
本研究提出的HyBRO策略通過“氫鍵重定向”機(jī)制,有效解決了傳統(tǒng)犧牲模板法在“適應(yīng)性”上的瓶頸。該策略不僅可精準(zhǔn)構(gòu)建高保真度(>90%)、多尺度(10倍跨越)通道網(wǎng)絡(luò),還廣泛兼容多類親水與疏水材料,并支持內(nèi)皮細(xì)胞的功能性生長及剪切力響應(yīng),實(shí)現(xiàn)了結(jié)構(gòu)與生理功能的協(xié)同重建,為再生醫(yī)學(xué)等領(lǐng)域的血管化構(gòu)建提供了一個通用兼容的新技術(shù)平臺。相關(guān)成果以 “A Highly Adaptable Hydrogen Bond Re-Orientation (HyBRO) Strategy for Multiscale Vasculature Fabrication” 為題發(fā)表于《Advanced Materials》。論文第一作者是澳門大學(xué)博士生(現(xiàn)博士后)廖禎誠博士,其也是前期設(shè)計(jì)非溶劑淬火打印技術(shù)的論文的第一作者。研究獲得澳門科技發(fā)展基金、國家自然科學(xué)基金、江蘇省自然科學(xué)基金及澳門大學(xué)科研基金的聯(lián)合資助。歡迎訪問課題組網(wǎng)站(https://sklqrcm.um.edu.mo/chun-ming-wang/)開展交流合作。
原文鏈接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/adma.202417734?af=R
