骨質疏松已成為老齡化社會嚴峻的公共健康問題,盡管治療骨質疏松的納米藥物已經取得了顯著效果,但是靜脈注射后的納米藥物大部分會被肝臟截留吸收,這是納米藥物遞送領域面臨的普適性難題,導致到達骨骼部位并發揮作用的藥物量較少,大大降低了藥物的生物利用度。基于以上科學問題,山東大學化學與化工學院崔基煒教授團隊聯合山東大學齊魯醫院骨科劉新宇教授團隊開發了一種負載藥物的靶向脂質體(TLipAM),通過靶向遞送藥物和調控肝-骨軸雙重機制,大大提高了藥物利用度,實現了骨質疏松的有效治療。該策略另辟蹊徑,將非特異性富集在肝臟部位的納米藥物變廢為寶,為納米藥物治療提供了新思路。該工作以“Integration of Bone-Targeted Delivery and Crosstalk Modulation of Liver-Bone Axis for Improved Osteoporosis Therapy”為題發表在ACS Nano上。山東大學齊魯醫院劉新宇教授、王連雷教授、高至亮副研究員和化學與化工學院崔基煒教授為該論文的共同通訊作者,山東大學博士后尤云昊為論文的第一作者。
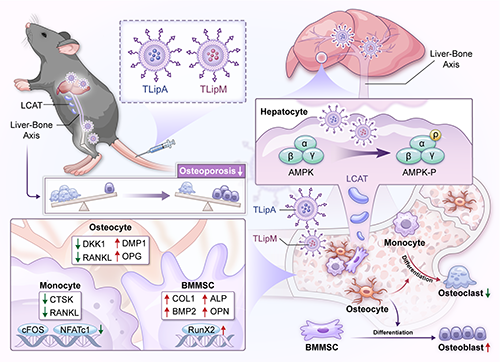
圖1. TLipA和TLipM可靶向骨組織遞送精氨酸和二甲雙胍,而在肝臟部位非特異性富集的脂質體通過調節肝-骨軸促進成骨作用并抑制破骨細胞生成。
該團隊開發了一種載有精氨酸和二甲雙胍的靶向脂質體(TLipA和TLipM)用于治療骨質疏松癥。一方面,修飾了阿倫磷酸的脂質體可以有效靶向骨組織,調節骨髓間充質干細胞、破骨細胞和成骨細胞,促進成骨的同時抑制破骨;另一方面,脂質體在肝臟中的非特異性富集增強了卵磷脂膽固醇脂酰轉移酶(LCAT)的分泌,而LCAT可以通過肝-骨軸調控成骨并抑制骨吸收,從而重新利用了肝臟部位非特異性富集的納米藥物。通過體內和體外實驗,這種靶向遞送和肝-骨軸調控的雙重機制能夠協同增強成骨并抑制破骨細胞的生成,在骨質疏松癥動物模型中具有顯著的治療效果。該團隊所報道的方法提高了納米藥物的生物利用度,對推動骨質疏松癥的治療具有重要意義。另外,該策略提供了一種利用不同器官之間的相互作用來增強納米藥物治療的新范式,對治療骨質疏松癥和其他疾病具有廣泛的借鑒意義。
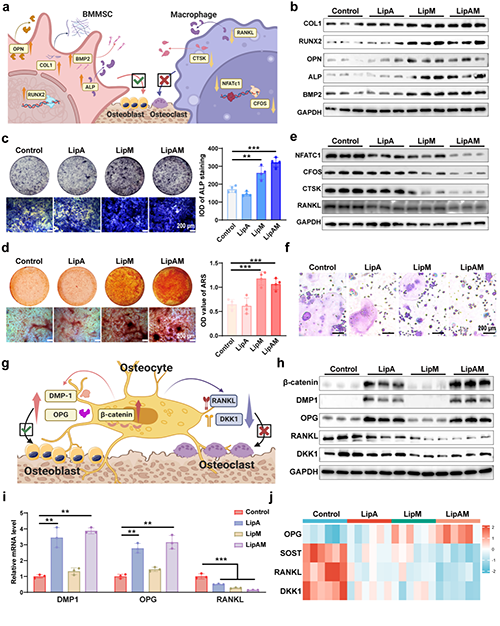
圖2. LipAM通過促進成骨分化和抑制破骨分化,調節骨細胞功能從而促進骨平衡向成骨方向發展。
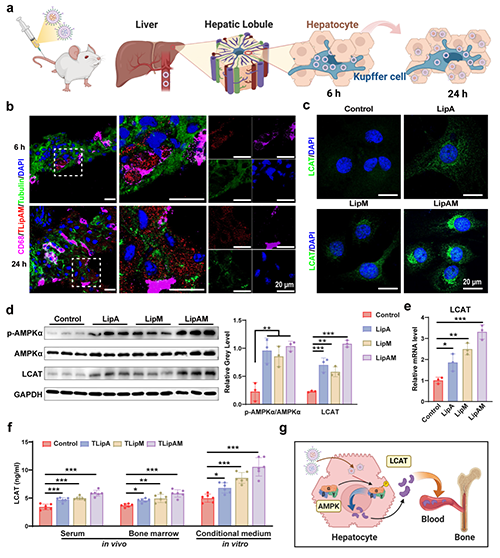
圖3. TLipAM在肝臟中的非特異性富集增強了LCAT的分泌。
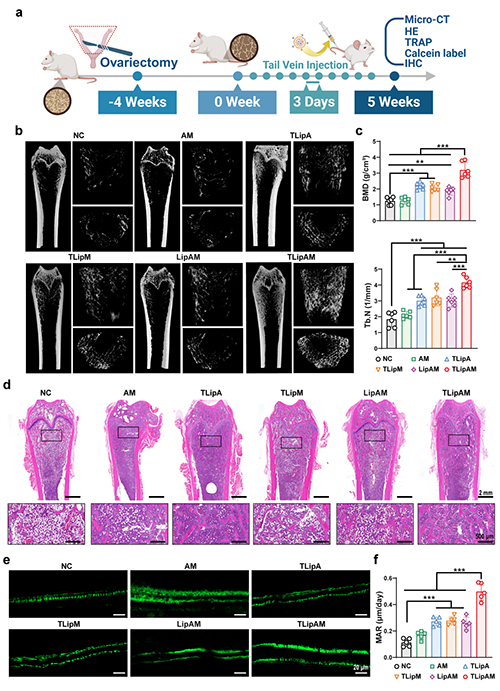
圖4. TLipAM有效解決了骨質疏松模型大鼠的骨質流失。
上述研究工作得到了國家自然科學基金、山東省自然科學基金的資助和支持。
原文鏈接:https://pubs.acs.org/doi/10.1021/acsnano.5c05460
- 長春應化所陳學思/宋萬通團隊《Mater. Horiz.》:基于聚氨基酸的脾靶向遞送mRNA的磷脂酰聚合物文庫 2024-04-03
- 山東大學崔基煒教授 Nano Today:原位中性粒細胞“搭便車”策略用于腫瘤術后化療-免疫聯合治療 2023-12-28
- 浙江大學高建青教授課題組《Adv. Funct. Mater. 》:在干細胞膜仿生囊泡多功能化和靶向遞送上取得新進展 2020-09-22
- 上海交大傅德皓教授團隊 ACS Nano: 仿生納米囊泡逆轉骨髓內皮細胞分泌表型治療骨質疏松癥 2022-07-13
- 華南師范大學黎錦明研究員團隊《ACS Nano》:上轉換納米粒光控誘導MSCs成骨分化治療骨質疏松 2022-06-27
- 蘇大李斌、韓鳳選團隊和北化柳朝永團隊 AFM:一種改善損傷微環境、調控免疫響應的多功能水凝膠修復骨質疏松性骨缺損 2022-03-22
