北京大學口腔醫院孫玉春教授、清華大學陳國強教授團隊《Chem. Eng. J》:多孔抗菌PHA支架修復口腔軟組織缺損
牙齦組織是口腔第一道保護屏障,有利于防止病原體和刺激物穿透組織屏障到達底層骨從而引起炎癥和骨吸收。角化齦或附著齦等軟組織修復再生對出現一系列病理狀況如牙齦退縮、感染、創傷、惡性腫瘤等的患者至關重要。膠原蛋白類材料是臨床上使用最廣泛的商業支架。然而,它們在大規模使用過程中也出現了較多的并發癥,如感染、免疫原性炎癥及修復速度慢等。其次,口腔環境中的細菌失衡可能引起如牙齦炎、牙周炎、種植體周圍炎等疾病發生,尤其是在軟組織缺損或植入牙齦移植物后的情況下。因此,具有抗菌性能的支架將有效減少傷口感染的機會,并最終提高膜齦手術的成功率。為牙齦組織再生制備合適的具有抗菌性能的生物材料仍一個巨大的挑戰。
近日,北京大學口腔醫院孫玉春教授團隊聯合清華大學生命科學學院/化工系陳國強教授團隊在《Chemical Engineering Journal》上發表了題為“Porous polyhydroxyalkanoates (PHA) scaffolds with antibacterial property for oral soft tissue regeneration”的研究論文。該研究基于第四代聚羥基脂肪酸酯(PHA)材料—P34HB(3-羥基丁酸和4-羥基丁酸共聚物),開發了一種“聚酯-金屬氧化物”復合的多孔抗菌支架(PAP34HB),并將其應用到口內軟組織在健康和感染條件下的修復過程中,與目前臨床上廣泛使用的膠原蛋白膜相比,均顯示出較好的抗菌和修復效果(圖1)。
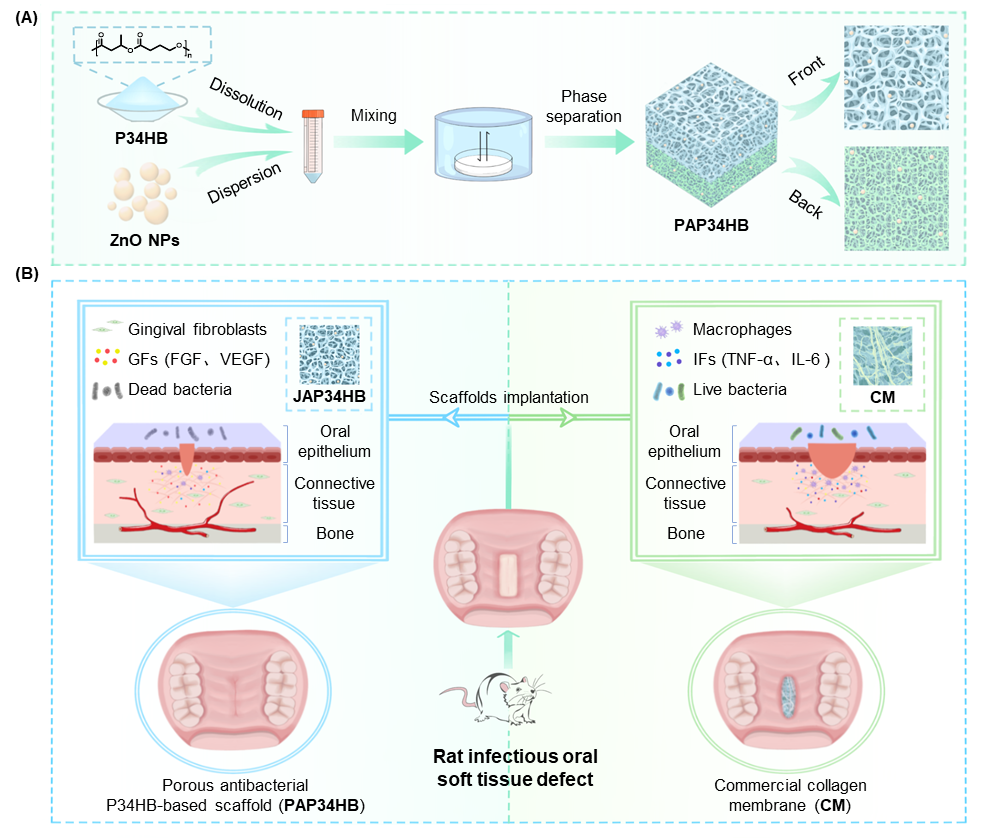
圖1. 基于P34HB的不對稱多孔抗菌支架的制備及應用。
在材料制備及表征方面,本研究使用簡便但高效的“top-down”溶劑交換方法,開發了一種基于P34HB的具有不對稱多孔結構:多孔海綿部分(主要)和低孔隙度致密層(圖2),并兼具適當力學性能的抗菌支架(PAP34HB)。在一定濃度的氧化鋅納米顆粒(ZnO NPs)的作用下,PAP34HB支架對口內常見細菌如牙齦卟啉單胞菌(Porphyromonas gingivalis)和變形鏈球菌(Streptococcus mutans)具有較好的抑制其生長和繁殖的作用(圖3)。
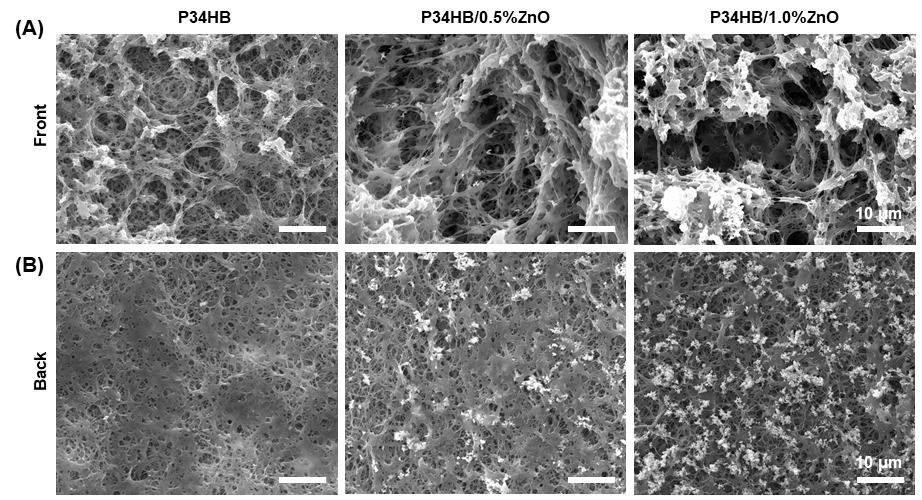
圖2. 基于P34HB的具有不對稱多孔結構支架微觀圖。

圖3. 基于P34HB的支架和商業膠原膜對牙齦卟啉單胞菌和變形鏈球菌的抗菌性能表征。
隨后的細胞實驗也證實,在保持優異的抗菌性能的基礎上,PAP34HB對人牙齦成纖維細胞(HGFs)和骨髓間充質干細胞(BMSCs)具有較好的生物相容性。尤其是在HGFs的體外細胞增殖研究中,與商業膠原蛋白膜相比,PAP34HB顯示出更好的生物相容性,這進一步體現了PAP34HB的優勢(圖4)。
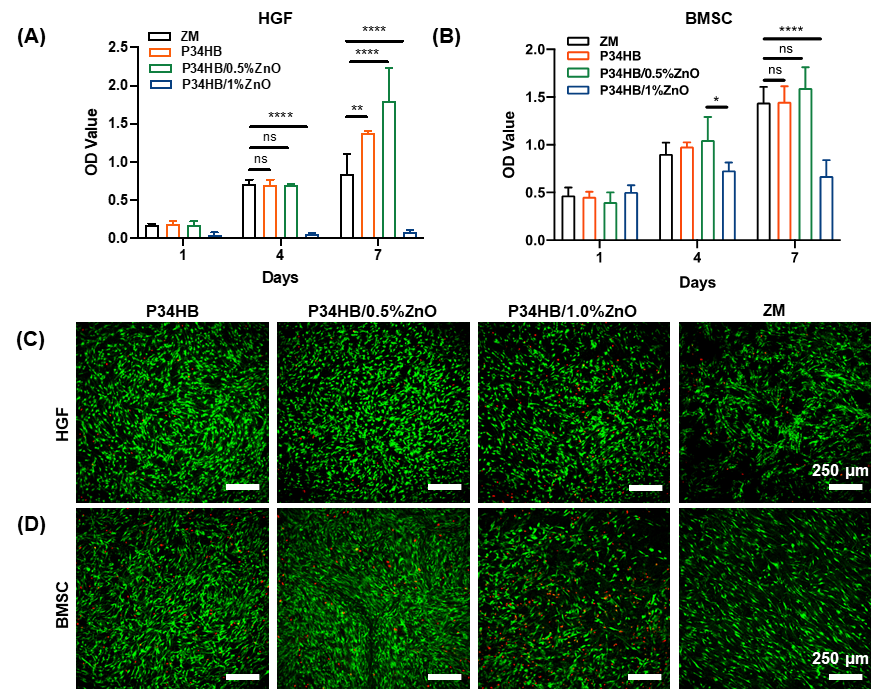
圖4. 基于P34HB的支架和商業膠原膜對HGFs和BMSCs的生長和增殖影響表征。
最后,基于PAP34HB支架(P34HB/0.5%ZnO組)保持共培養細胞活力的同時表現出優異的抗菌活性,本研究設計了口內非感染和感染性軟組織缺損模型評估該組PAP34HB支架在體內口腔軟組織修復和再生的作用。在非感染性軟組織缺損模型中,術后7天觀察,空白對照組仍然可以觀察到腫脹和微紅的傷口,P34HB及PAP34HB組的傷口炎癥消退,邊緣明顯閉合,上皮靠攏,釘突顯著延長,膠原纖維排列有序,表現出較好的修復和再生能力。而在兩組膠原膜的結締組織中仍發現大量炎癥細胞,表明有過度免疫反應。在口內感染性軟組織缺損模型中,術后7天觀察,空白對照組的水腫嚴重,傷口充滿組織碎片,組織結構紊亂不清。PAP34HB組傷口缺損基本恢復,無軟組織凹陷,上皮化程度明顯更好,未見明顯炎癥反應或瘢痕,顯示完整的牙齦上皮和排列有序的結締組織。相反,兩組商業膠原膜的傷口邊緣腫脹并變紅,傷口凹陷,存在結構未完全修復的殘余傷口,同時可見大量炎性細胞聚集,缺乏完整的牙齦上皮,再生的膠原纖維也較為松散。以上結果表明,與臨床常用的膠原蛋白膜相比,PAP34HB支架顯示出顯著的牙齦修復效果(圖5)。
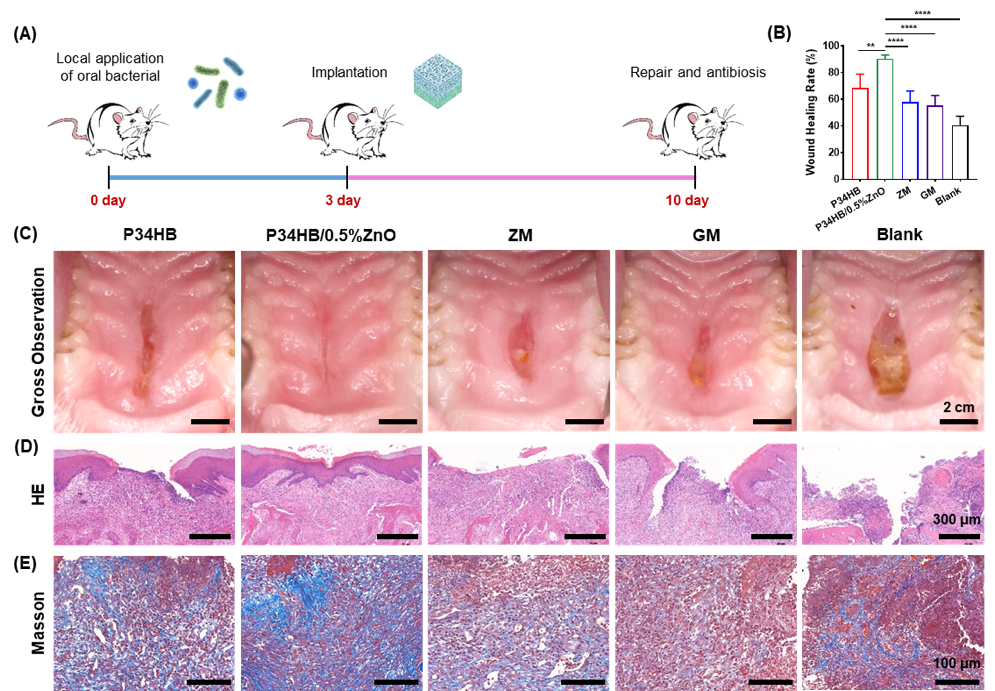
圖5. PAP34HB支架在感染口腔軟組織缺損模型中顯示出顯著的修復和抗菌抗炎能力。
綜上所述,本研究成功構建了一類基于PHA的具有合適仿生拓撲結構的口內軟組織修復支架,具有促細胞增殖、抗菌、消炎能力,對感染性口腔軟組織缺損具有顯著的修復再生作用,表現出較大的潛在臨床應用前景和價值,進一步推動了微生物聚合物尤其是PHA材料在口腔修復領域內的應用發展。
北京大學口腔醫院博士生陳凡凡及清華大學生命學院博士生劉心怡為論文的共同第一作者,北京大學口腔醫院口腔醫學數字化研究中心副主任、中國醫療器械行業協會口腔專委會理事長、口腔生物材料和數字診療裝備國家工程研究中心“口腔智能技術和裝備平臺”負責人孫玉春教授和清華大學生命學院/化工系陳國強教授、張旭博士為論文的共同通訊作者。北京大學口腔醫院葛兮源研究員、王勇教授及博士生趙梓帆參與該研究。該研究得到了首都科技(創新)領軍人才項目、科技部重大專項、國家自然科學基金委、清華大學-北京大學生命科學聯合中心、清華-INDITEX持續發展基金的資助。
原文鏈接:https://doi.org/10.1016/j.cej.2022.138899 https://www.sciencedirect.com/science/article/pii/S1385894722043789





