細菌納米纖維素(Bacterial nanocellulose,BNC)管在小口徑人工血管領域具有極大的應用潛力,然而水凝膠態下,力學性能弱、縫合強力較低和順應性不足等問題,也一定程度上限制了BNC管的應用。雖然目前可以通過濃堿處理來制備絲光化BNC(Mercerized BNC,MBNC)以提升BNC管的力學性能,但是其縫合強力仍然較低,彈性較差,這使得BNC及MBNC管的手術操作變得相對困難。因此,東華大學洪楓教授團隊結合了濃堿處理技術和水溶性彈性高分子材料聚乙烯醇(Polyvinyl alcohol,PVA)的冷凍相分離技術,制備了具有彈性的絲光化BNC/PVA復合小口徑人工血管(MBP),評估了其應用潛力。該成果以Production of novel elastic bacterial nanocellulose/polyvinyl alcohol conduits via mercerization and phase separation for small-caliber vascular grafts application為題,發表于International Journal of Biological Macromolecules上。

聚乙烯醇的引入——絲光化BNC/PVA復合管結構與物理性能的變化
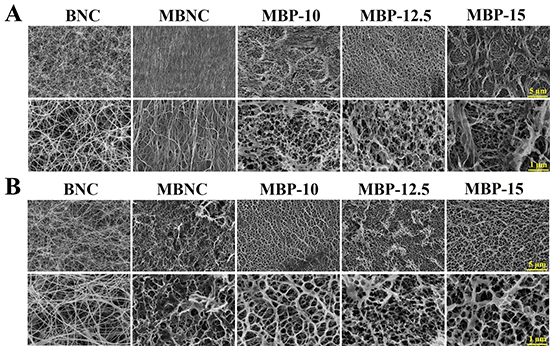
圖2 BNC、MBNC和MBP管的微觀形貌(FE-SEM):(A)內表面;(B)外表面。
由于PVA會在堿溶液中發生沉淀,因此PVA在BNC網絡中的沉積在一定程度上抑制了絲光化過程中BNC的體積收縮。所以,與MBNC相比,MBP管的體積收縮率更低(見圖3B)。樣品的持水量如圖3C所示,BNC的持水量為197.66 mL/g,遠高于MBNC和MBP管,由于絲光處理和PVA的引入,MBNC和MBP管持水能力下降。
與BNC相比,MBP管的軸向楊氏模量、徑向拉伸強度和爆破壓力隨著PVA含量的增加而提高,但其數值仍低于MBNC管(見圖3D、圖3E和圖3H)。此外,圖3F為BNC、MBNC和MBP管的應力應變曲線,PVA的引入改變了其力學拉伸特性,并且MBP管也具有遠高于BNC和MBNC的縫合強力,并隨著PVA含量的增加而提高(圖3G),變得利于手術操作。
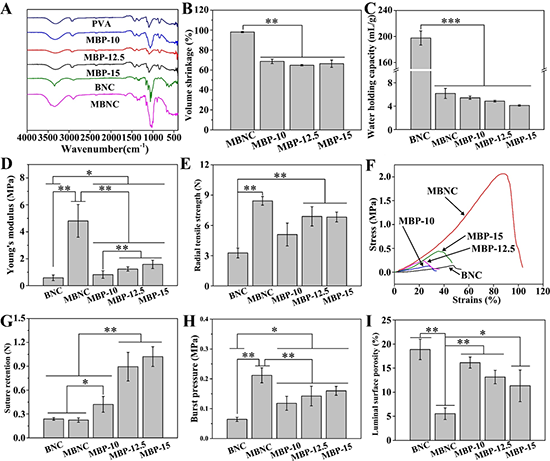
圖3 BNC、MBNC和MBP管的物理化學性質:(A)傅里葉全反射紅外光譜;(B)體積收縮率;(C)持水量;(D)軸向楊氏模量;(E)徑向拉伸強度;(F)應力-應變曲線;(G)縫合強力;(H)爆破壓;(I)表面孔隙率。*代表0.01<p<0.05,**代表p<0.01,#代表無顯著性差異p>0.05

圖4 MBP管的循環蠕變-恢復試驗:(A)力-應變曲線和(B)應變-時間曲線;(C)MBP管的循環應力保持試驗(黑線:力-時間曲線;紅線:應變-時間曲線)。
體外生物相容性的評估
圖5A為BNC、MBNC和MBP管的BSA蛋白吸附量結果。BNC的蛋白吸附量最高,為59.53 μg/cm2,MBNC、MBP-10、MBP-12.5和MBP-15上的BSA吸附量分別為5.30 μg/cm2、21.68 μg/cm2、14.56 μg/cm2和5.31 μg/cm2,均顯著低于BNC的蛋白吸附量。根據ISO 10993-4:2002,血液接觸類醫療器械的溶血率應低于5%。圖5B的溶血率結果顯示BNC、MBNC和MBP管的溶血率均低于0.25%,說明其不會造成溶血,符合相關標準。
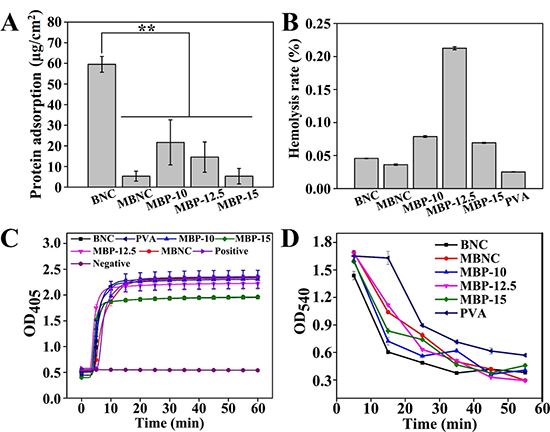
圖5 BNC、MBNC和MBP管的血液相容性:(A)蛋白吸附量;(B)溶血率;(C)血漿復鈣動力曲線;(D)全血凝固時間。(PVA膜作為對照)**代表p<0.01
全血凝固實驗的結果如圖5D所示,在全血凝固實驗的終點PVA膜的OD值高于于BNC、MBNC和MBP管,其原因可能在于BNC基人工血管表面的纖維和多孔結構可能可以吸附更多的蛋白質。此外,需要特別注意的是,在與血液接觸35分鐘內,MBNC和MBP管在OD540的吸光度均高于BNC,表明在與血液接觸的一段時間內MBNC和MBP管上的血液比BNC管凝固得更慢。
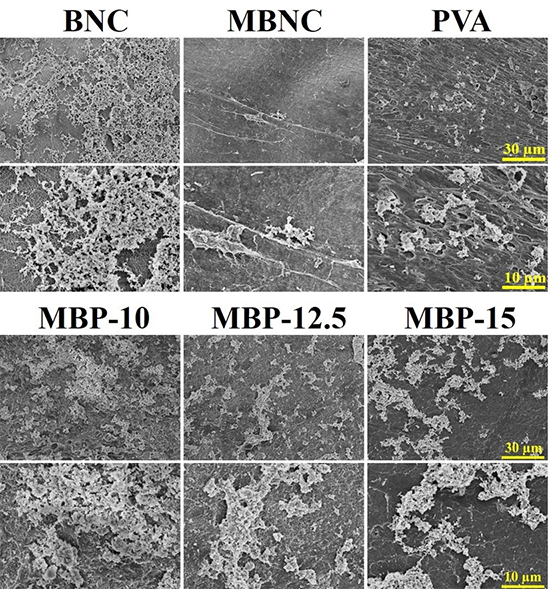
圖6 BNC、MBNC和MBP管內表面的血小板粘附量(PVA膜作為對照)
根據ISO 10993-12:2021的相關標準,采用共培養法所測定HUVECs細胞存活率來測定BNC、MBNC和MBP管材的細胞毒性。圖7A為共培養法所得HUVECs的細胞存活率,細胞存活率均高于80%,無明顯細胞毒性。

圖7 BNC、MBNC和MBP管的細胞相容性:(A)共培養法所得HUVECs的細胞存活率;(B)HUVEC的在樣品內表面的增殖情況。*代表0.01<p<0.05,**代表p<0.01,#代表無顯著性差異p>0.05
MBP管的體內功效評估——SD大鼠腹主動脈移植實驗
用MBP-12.5小徑管替換SD大鼠的部分腹主動脈以詳細評估其體內生物相容性。圖8A為SD大鼠腹主動脈移植實驗的示意圖以及多普勒超聲圖像結果。其結果顯示,在植入1周、4周、8周、12周、16周、20周和32周這幾個時間點,MBP-12.5管腔內可以觀察到正常的血流信號,血流正常,表明MBP-12.5在腹主動脈移植后保持了相對滿意的遠期通暢率。
在MBP-12.5替換腹主動脈32周后,以SD大鼠的自體血管為對照,用組織學染色和免疫熒光染色研究MBP-12.5上的組織形成情況。圖8B為MBP-12.5替換腹主動脈32周的組織學染色和免疫熒光染色結果,其中自體血管的橫截面被稱為Control,MBP-12.5管中段的橫截面被稱為Cross section,MBP-12.5管的軸向橫截面被稱為Axial section,MBP管與自體血管吻合處的橫截面被稱為Anastomosis,以研究植入的效果(圖8B)。圖8B中的紅色熒光(CD31)為內皮細胞,綠色熒光(α-SMA)為平滑肌細胞,藍色熒光(DAPI)為細胞核。在樣品中段橫截面(Cross section)、血管吻合處橫截面(Anastomosis)和樣品軸向橫截面(Axial section)中均可觀察到內皮細胞的紅色熒光、平滑肌細胞的綠色熒光及細胞核的藍色熒光,表明MBP-12.5管腔的內部形成了內皮層,并且在內皮層的下方有平滑肌細胞生成。Control中CD31的熒光比其他樣本中的熒光更亮、更清晰,這意味著MBP-12.5的管腔內部雖然有內皮層的再生,但是內皮層的再生效果可能并沒有自體血管好。此外,組織學染色結果(H&E以及Masson)也與免疫熒光的結果相對應。

圖8 (A)MBP-12.5的植入示意圖以及其植入后1-32周的多普勒彩超;(B)MBP-12.5植入32周的免疫熒光染色結果、H&E染色結果和Masson染色結果(每組黃色和紅色虛框內的放大結果均在其下方顯示)
全文下載鏈接:https://doi.org/10.1016/j.ijbiomac.2023.124221
- 中科院納米能源所李舟課題組 Nano Energy:界面誘導高壓電γ-甘氨酸可降解柔性薄膜 2023-12-30
- 山東農大劉峰教授團隊 ACS Nano:界面穿梭效應介導的界面聚合深度變化調控載藥微膠囊的應用性能 2023-10-09
- 華東理工大學陳彧教授團隊《ACS AMI》:水溶性聚噻吩共軛聚電解質基瞬態憶阻器 2022-08-23
- 東南大學張久洋教授課題組 AM:超靈敏金屬-粘彈性高分子復合電子材料用于環境增強感知 2023-12-13
- 東華大學洪楓教授團隊《CEJ》:絲光處理細菌納米纖維素管以調控小口徑人工血管的尺寸和性能 2021-10-20
- 蘇大李剛教授、牛津大學Kaili Chen博士合作 JMST:人工血管研究進展 2025-01-05
- 華南理工大學王小慧/廣東省心血管病研究所陳寄梅團隊 CEJ:植物纖維素基雙網絡仿生小口徑人工血管 2023-11-21
