浙江大學(xué)張鵬研究員 Nat. Commun.:具有內(nèi)在抗異物反應(yīng)能力的免涂層免疫相容彈性體
可植入生物材料和生物醫(yī)學(xué)器件植入后所引起的異物反應(yīng)(Foreign Body Response, FBR)會嚴(yán)重阻礙其功能,甚至導(dǎo)致失效。對于彈性體基材來說,開發(fā)生物相容性表面涂層是目前廣泛接受的抗異物反應(yīng)方法,但其應(yīng)用仍面臨若干挑戰(zhàn)。首先,具有持久抗異物反應(yīng)性能的材料依然稀缺,有些材料需要復(fù)雜的化學(xué)合成和純化過程。其次,復(fù)雜的涂層工藝不適合大規(guī)模工業(yè)生產(chǎn)。第三,不均勻的涂層應(yīng)用和覆蓋不足進(jìn)一步影響效果。最后,在復(fù)雜的生理環(huán)境中,涂層脫落的問題也構(gòu)成重大挑戰(zhàn)。克服植入彈性體材料的異物反應(yīng),開發(fā)具有高度免疫相容性的生物材料仍是一個(gè)艱巨的任務(wù)。

圖1 商用PDMS彈性體與EVADE彈性體的外觀與化學(xué)結(jié)構(gòu)
近期,浙江大學(xué)高分子科學(xué)與工程學(xué)系張鵬研究員開發(fā)了一類免疫相容的免涂層彈性體材料,稱為EVADE彈性體。EVADE 材料在嚙齒動物的皮下模型中有效抑制了炎癥和纖維囊形成長達(dá)一年,在非人類靈長類動物的皮下模型中達(dá)到兩個(gè)月。與聚二甲基硅氧烷(PDMS)相比,EVADE 材料的植入顯著降低了鄰近組織中與炎癥相關(guān)的蛋白質(zhì) S100A8/A9 的表達(dá)。他們還發(fā)現(xiàn),抑制或敲除 S100A8/A9 可以顯著減輕小鼠的纖維化,表明這是一個(gè)抑制纖維化反應(yīng)的新靶點(diǎn)。由 EVADE 彈性體制成的持續(xù)皮下胰島素輸注(CSII)導(dǎo)管在耐久性和性能上顯著優(yōu)于商業(yè)導(dǎo)管。這里所報(bào)告的 EVADE 材料有望通過抵抗局部免疫反應(yīng)來增強(qiáng)和延長各種醫(yī)療設(shè)備的功能。這項(xiàng)研究突破了在彈性體表面構(gòu)建免疫相容性涂層的傳統(tǒng)方法,揭示了抵抗纖維化反應(yīng)的新靶點(diǎn),為可植入醫(yī)療器械的免疫相容性材料提供了全新的選擇。該工作以“Immunocompatible elastomer with increased resistance to the foreign body response”為題發(fā)表在《Nature Communications》上(Nat. Commun. 2024,15, 7526)。文章第一作者是浙江大學(xué)博士生周咸池。該研究得到國家自然科學(xué)基金委的支持。


圖2 EVADE彈性體在小鼠皮下植入一個(gè)月后所引發(fā)的纖維化反應(yīng)評估
EVADE材料基于四氫吡喃醚衍生的甲基丙烯酸酯免疫調(diào)節(jié)單體HPEMA(圖1)。該單體易于合成,并能通過自由基聚合反應(yīng)實(shí)現(xiàn)聚合。為了在聚合物結(jié)構(gòu)中引入物理可交聯(lián)的部分,他們將HPEMA與丙烯酸十八酯(ODA)共聚。ODA具有長烷基鏈,可以在共聚物中形成微晶,從而實(shí)現(xiàn)物理交聯(lián)。共聚物通過本體聚合制備,并以HPEMA的摩爾分?jǐn)?shù)命名。例如,由90 mol% HPEMA和10 mol% ODA組成的共聚物被命名為H90。
他們選擇了三個(gè)樣品 H50、H70 和 H90 ,進(jìn)行進(jìn)一步的體內(nèi)植入測試,以評估它們的纖維化反應(yīng),并與常用醫(yī)用彈性體 PDMS 進(jìn)行比較。實(shí)驗(yàn)中,他們對 C57BL/6 小鼠進(jìn)行了皮下植入,每只小鼠的背部植入了所有四個(gè)樣品。經(jīng)過一個(gè)月的植入期后,他們?nèi)〕隽藦椥泽w片。代表性的照片和組織學(xué)圖像見圖2。組織學(xué)染色(包括 Masson 三色染色和蘇木精-伊紅 (H&E) 染色)顯示,EVADE 材料(特別是 H90)形成了厚度為 10 至 40 微米的纖維化囊,而 PDMS 植入物的纖維化囊厚度則為 45-135 微米。我們還將 H90 與其他四種常用的生物醫(yī)用可植入聚合物進(jìn)行比較,分別是乙烯-甲基丙烯酸酯共聚物 (EMA)、熱塑性聚氨酯(TPU)、聚烯烴彈性體 (POE) 和聚酰胺 (PA)。如圖2所示,植入 H90 后幾乎未形成任何纖維囊,而其他所有材料均形成了 35 至 160 微米厚的纖維化包膜。這表明 EVADE 材料具有優(yōu)異的免疫相容性。
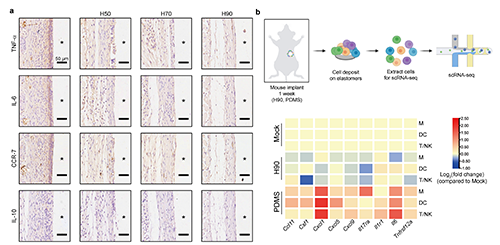
圖3 EVADE彈性體在小鼠皮下植入兩周后所引發(fā)的炎癥反應(yīng)評估
他們研究了 EVADE 材料在 C57BL/6 小鼠皮下植入兩周后引發(fā)的急性炎癥反應(yīng),觀察到 H90 僅引起非常微弱的炎癥反應(yīng)。首先,他們通過免疫組織化學(xué)切片分析了促炎標(biāo)志物 CCR-7、TNF-α 和 IL-6 以及抗炎標(biāo)志物 IL-10,以評估彈性體植入對周圍組織炎癥水平的影響(如圖 2a)。結(jié)果顯示,PDMS 顯著增加了彈性體與組織界面處的炎癥標(biāo)志物,而 EVADE 材料的炎癥標(biāo)志物表達(dá)明顯較低,其中 H90 的表現(xiàn)最為顯著(約為 PDMS 彈性體周圍組織中觀察到的 1/6 到 1/8)。盡管如此,抗炎標(biāo)志物 IL-10 的表達(dá)在 EVADE 和 PDMS 彈性體之間沒有顯著差異。接著,他們提取了植入物周圍的細(xì)胞,并進(jìn)行了單細(xì)胞 RNA 測序 (scRNA-seq) 分析,以檢查免疫細(xì)胞的組成和基因表達(dá)(如圖 2b)。通過單細(xì)胞轉(zhuǎn)錄組的 k 均值聚類分析,他們識別出八種細(xì)胞類型中的三個(gè)主要簇:巨噬細(xì)胞、樹突狀細(xì)胞和 T/自然殺傷細(xì)胞。基因分析表明,H90 的植入引發(fā)了免疫細(xì)胞中炎性細(xì)胞因子、趨化因子和集落刺激因子的廣泛下調(diào)。

圖4 皮下植入后24小時(shí),從回收的彈性體表面提取的蛋白質(zhì)裂解物的蛋白質(zhì)組學(xué)分析
蛋白質(zhì)吸附是異物反應(yīng)過程中至關(guān)重要的初始步驟,研究植入物植入早期后表面蛋白質(zhì)的吸附情況,有助于深入了解EVADE材料降低異物反應(yīng)的機(jī)制。他們通過蛋白質(zhì)組學(xué)鑒定了植入后24小時(shí)吸附在H90和PDMS表面的蛋白質(zhì)種類(圖3)。結(jié)果顯示,在24小時(shí)內(nèi),白蛋白是 PDMS 和 H90 材料表面吸附量最大的蛋白質(zhì)。在 PDMS 表面,炎癥相關(guān)蛋白 S100A8 和 S100A9 的比例較高,分別為 7.2% 和 13.1%,而在 H90 表面的吸附量則顯著較低,分別為 3.5% 和 7.4%。這些結(jié)果表明,S100A8/A9 蛋白的表達(dá)和吸附可能會加劇炎癥反應(yīng),進(jìn)而促進(jìn)體內(nèi) FBR 的發(fā)生。

圖5 S100A9藥物抑制模型與S100A8基因敲除模型的構(gòu)建與纖維化反應(yīng)評估
盡管大量研究支持 S100A8/A9 蛋白在炎癥反應(yīng)中的作用,但尚無直接證據(jù)表明抑制這些蛋白的表達(dá)可以減輕植入物的異物反應(yīng)。基于結(jié)果,他們假設(shè)抑制 S100A8/A9 表達(dá)可能有助于降低植入物的異物反應(yīng)。為驗(yàn)證這一假設(shè),他們首先測試了S100A9 抑制劑 tasquinimod (TAS) 對 PDMS 片的纖維化反應(yīng)。TAS 是一種口服活性喹啉-3-甲酰胺,具有與組蛋白去乙酰化酶 4 (HDAC4) 和 S100A9 高親和力的結(jié)合。在 PDMS 植入后 30 天內(nèi),通過每日飲用水向小鼠提供兩種劑量的 TAS(1 mg/kg 和 3 mg/kg)(見圖 4a-c)。Masson 切片顯示,TAS 組 PDMS 周圍的膠原沉積明顯減少,纖維囊厚度約為未施用 TAS 時(shí)觀察到的 1/2 至 1/3 倍,表明PDMS片的異物反應(yīng)得到抑制。此外,他們還構(gòu)建了 S100A8 敲除 (KO) 小鼠模型,通過將 Floxed-S100A8 轉(zhuǎn)基因 (Tg) 小鼠與 LysM-Cre Tg 小鼠雜交(見圖 4d-f)。將 PDMS 圓盤植入皮下一個(gè)月后,組織學(xué)結(jié)果顯示,S100A8 敲除的小鼠中幾乎觀察不到纖維化囊形成。綜上所述,這些發(fā)現(xiàn)表明 S100A8/S100A9蛋白在材料植入后的纖維化過程中起著關(guān)鍵作用,降低這些蛋白的表達(dá)可以有效減輕材料誘導(dǎo)的異物反應(yīng)。
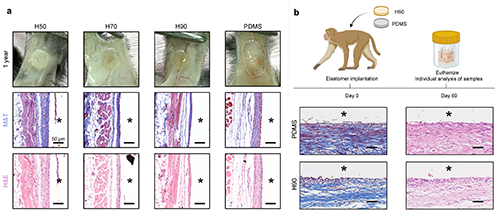
圖6 小鼠長期植入模型與非人靈長類植入模型驗(yàn)證
生物材料抵抗長期纖維囊形成的能力對維持體內(nèi)植入裝置的功能至關(guān)重要。為評估這一點(diǎn),他們進(jìn)行了為期一年的植入研究,并在十二個(gè)月后取回彈性體樣品進(jìn)行纖維化評估。所有 H90 彈性體樣品均顯示出清晰的輪廓,并被較薄的纖維囊包圍,如數(shù)碼照片和 M&T 染色所示(見圖 5a)。相比之下,對照的 PDMS 彈性體在植入后形成了厚厚的膠原層,植入十二個(gè)月后完全被覆蓋。為了將這些發(fā)現(xiàn)擴(kuò)展到更高級的物種,他們在健康的食蟹猴皮下植入了 H90 和 PDMS 彈性體片(見圖 5b)。兩個(gè)月后取出植入物并進(jìn)行分析。Masson 三色染色顯示,PDMS 樣品中存在顯著的纖維化反應(yīng)(最多 180 μm),而 H90 的膠原層較薄(最多 60 μm)。值得注意的是,在兩只實(shí)驗(yàn)猴中沒有觀察到纖維化包裹現(xiàn)象。
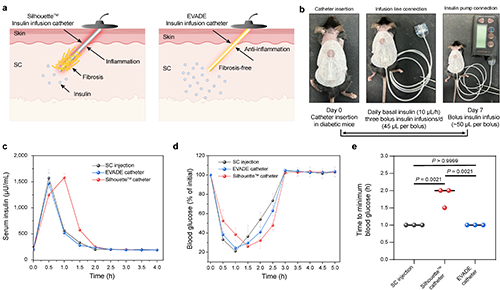
圖7 EVADE彈性體制成的胰島素輸注導(dǎo)管在糖尿病小鼠體內(nèi)保持了長期功能
他們進(jìn)一步開發(fā)了由 EVADE 材料制成的輸注導(dǎo)管,并在糖尿病小鼠模型中評估了它們在標(biāo)準(zhǔn)泵治療條件下的性能(見圖 6)。EVADE 輸注導(dǎo)管被植入小鼠皮下并用粘合劑固定,同時(shí)市售的 Silhouette 導(dǎo)管作為對照。為了測試 EVADE 導(dǎo)管在自然微運(yùn)動下的表現(xiàn),他們將導(dǎo)管連接到輸注管線,并讓小鼠攜帶輸注器長達(dá) 7 天。隨后,將導(dǎo)管連接到胰島素泵(Medtronic MiniMed 722)以評估在持續(xù)胰島素輸注期間的功能。小鼠以 10 μL/h 的速率接受持續(xù)基礎(chǔ)胰島素輸注,并每次進(jìn)行 45 μL 的胰島素推注(見圖 6b)。植入后第 7 天,通過胰島素泵進(jìn)行了推注輸注的胰島素吸收試驗(yàn)。與標(biāo)準(zhǔn)皮下(SC)注射相比,通過 Silhouette 導(dǎo)管輸送的胰島素吸收延遲了 0.5-1 小時(shí),而通過 EVADE 導(dǎo)管輸送的胰島素則表現(xiàn)出與 SC 注射一致的藥代動力學(xué)特征(見圖 6c-e)。因此,EVADE 輸注器產(chǎn)生的血糖效應(yīng)與傳統(tǒng)的 SC 胰島素注射相當(dāng),這通過給藥后 1 小時(shí)的最低血糖水平得以體現(xiàn)。相對而言,Silhouette 輸注器表現(xiàn)出明顯的藥理作用延遲,最低血糖水平比 EVADE 組晚 0.5-1 小時(shí)。這些發(fā)現(xiàn)凸顯了 EVADE 材料通過減少局部免疫反應(yīng)來改善植入式生物醫(yī)學(xué)設(shè)備體內(nèi)性能的潛力。
該工作是該團(tuán)隊(duì)近期在免疫相容性材料研究方面的最新進(jìn)展之一。傳統(tǒng)的可植入生物材料和醫(yī)療器械在植入后常常引發(fā)強(qiáng)烈的異物反應(yīng),這會對器械的功能產(chǎn)生極大影響。為應(yīng)對這一挑戰(zhàn),團(tuán)隊(duì)發(fā)展了一系列免疫相容材料和表面修飾方法,系統(tǒng)探索了植入材料的化學(xué)結(jié)構(gòu)與免疫相容性之間的關(guān)系,并揭示了全新的抗纖維化生物靶點(diǎn)。在過去的一年中,團(tuán)隊(duì)開發(fā)了一系列基于兩性離子材料的免疫相容水凝膠材料(Adv. Sci., 2024, 11, 2308077; Biomater. Sci., 2024, 12, 468)、免疫相容彈性體材料(Acta Biomater., 2024, DOI: 10.1016/j.actbio.2024.06.047)以及基于天然白蛋白的免疫相容表面改性方法(Bioact. Mater., 2024, 34, 482)。
原文鏈接:https://www.nature.com/articles/s41467-024-52023-z








