硬度是納米顆粒重要的物理化學性質,已被證明對納米-生物相互作用具有顯著影響,包括血液循環、體內分布、腫瘤積累和細胞攝取等藥物遞送過程。在已報道的工作中,納米顆粒的楊氏模量(EY)分布范圍較大,納米顆粒的EY遠大于哺乳動物細胞的EY(2–26 kPa),導致體外和體內實驗結果存在顯著差異。因此設計EY與哺乳動物細胞相近的納米顆粒,對于研究納米-生物相互作用,增強藥物遞送效率具有重要研究價值。近日,山東大學崔基煒教授團隊利用層層組裝法(LbL)制備了一系列不同硬度(2–31 kPa)的聚乙二醇(PEG)納米顆粒,探究了納米顆粒的硬度對納米-生物相互作用的影響。值得注意的是,柔軟的PEG納米顆粒(EY~2 kPa)表現出了最佳的藥物遞送效率和腫瘤治療效果,這對未來納米藥物載體的設計提供了一種有前景的手段。該工作以“Multilayered Nanoarchitectonics of Poly(ethylene glycol) Nanoparticles with Tunable Stiffness Modulate Bio-Nano Interactions and Targeted Drug Delivery”為題發表在ACS Nano上。山東大學化學與化工學院崔基煒教授為該論文的通訊作者,山東大學博士研究生李夢琦為該論文的第一作者。
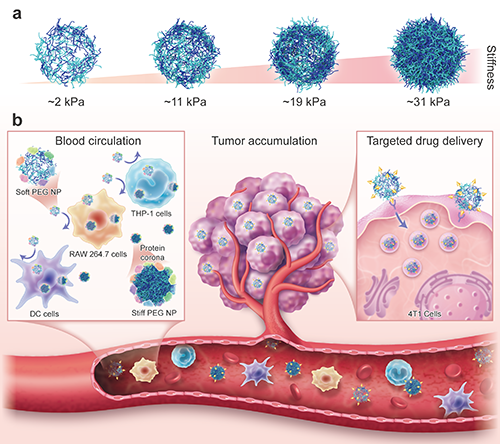
圖1 (a)通過調控LbL組裝的層數制備不同硬度PEG納米顆粒的示意圖。(b)通過調控納米顆粒的硬度可以降低蛋白質在納米顆粒表面的吸附和單核吞噬系統的清除,增強了納米顆粒在腫瘤部位的積累和腫瘤細胞的攝取,提高了納米顆粒的靶向遞送效率。
納米顆粒的硬度是影響納米藥物載體體內命運的重要因素,目前各種具有不同EY的納米顆粒(如高分子納米顆粒、二氧化硅納米顆粒和脂質體等)被制備出來,其EY范圍跨越多個數量級從0.2 kPa到9.7 GPa,遠大于哺乳動物細胞的EY (例如2–26 kPa),這種差異導致體外和體內的實驗結果存在顯著差異。因此開發硬度處于細胞EY范圍的納米顆粒,可以更精確地模擬生理微環境中的力學相互作用,優化納米藥物載體的設計,提高藥物遞送效率具有重要意義。在該研究中,團隊發現通過改變LbL組裝的層數可以制備一系列不同硬度(2-31 kPa)的PEG納米顆粒(圖1)。原子力顯微鏡(AFM)測量結果顯示,隨著組裝層數的增加,PEG納米顆粒的硬度也逐漸增大(圖2)。此外該團隊研究了PEG納米顆粒的硬度對納米-生物界面相互作用的影響。研究發現與硬的PEG納米顆粒相比,柔軟的PEG納米顆粒由于降低了蛋白質在其表面的吸附,與巨噬細胞、單核細胞和樹突狀細胞的相互作用減少,延長了其在血液中的循環時間,并減少了肝臟的積累,為提高藥物遞送提供了可能(圖3,圖4)。為了進一步提高納米顆粒的腫瘤靶向遞送效果,進一步利用透明質酸(HA)修飾負載順鉑的PEG納米顆粒,體內實驗結果表明,較軟的靶向PEG納米顆粒在腫瘤部位的積累更多(圖五),從而增強了抗癌藥物順鉑的靶向遞送,有效抑制腫瘤生長。總的來說,該團隊通過LbL組裝的方法來調節納米顆粒的硬度為調節納米-生物相互作用和提高藥物遞送效率提供了一種新的途徑。
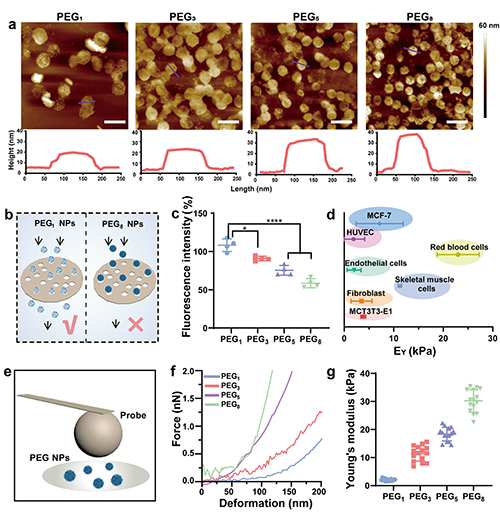
圖2(a)PEG納米顆粒在氣相中的AFM圖像和高度分布圖,標尺尺寸為300 nm。(b)PEG納米顆粒通過孔徑為100 nm濾頭的示意圖。(c)定量PEG納米顆粒穿過率的熒光統計。(d)哺乳動物細胞的EY,包括 MCT3T3-E1、成纖維細胞、骨骼肌細胞、內皮細胞、紅細胞、HUVEC和MCF-7細胞。(e)球形AFM探針示意圖。(f)PEG納米顆粒的力-變形曲線。(g)Hertzian模型擬合計算PEG納米顆粒的EY(n = 15)。
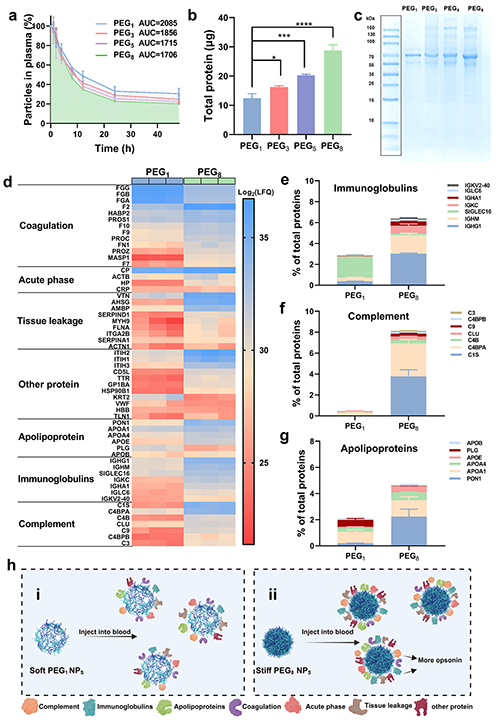
圖3(a)靜脈給藥后,小鼠血液中PEG納米顆粒的濃度–時間分布(n = 3)。(b)BCA 測定PEG納米顆粒表面上蛋白吸附的含量(n = 3)。(c)與牛血清蛋白共培養后的 PEG納米顆粒上細胞蛋白的SDS-PLGA分析圖。(d)PEG納米顆粒上吸附的蛋白質的統計熱圖。(e-g)PEG 納米顆粒上的蛋白冠統計,根據其在血液系統中的生物學功能分類(n = 3)。(h)PEG NPs上蛋白質吸附示意圖。

圖4在培養12 h后,PEG納米顆粒與(a)RAW 264.7和(b)THP-1細胞的相互作用(n = 3)。(c)PEG納米顆粒與 Raw 264.7細胞共培養12 h后的共聚焦圖像。(d)注射PEG納米顆粒,12 h后,小鼠主要臟器中PEG納米顆粒的熒光圖像。(e)主要臟器的熒光統計分析(n = 3)。(c)PEG 納米顆粒與免疫細胞的相互作用及其在小鼠體內的生物分布示意圖。

圖5流式細胞儀定量分析(a)PEG納米顆粒和(b)靶向PEG納米顆粒與4T1細胞共培養12 h后的細胞相互作用(n = 3)。(c)靶向PEG 納米顆粒與4T1細胞共培養12 h的共聚焦圖像。(d)納米顆粒注射12 h后,小鼠主要器官中靶向PEG納米顆粒分布的熒光圖像。(e)流式細胞儀定量分析,內吞抑制劑對4T1細胞攝取靶向PEG納米顆粒的影響(n = 3)。(f)小鼠主要臟器的熒光定量統計分析(n = 3)。
上述研究工作得到國家自然科學基金、山東省自然科學基金的資助和支持。
原文鏈接:https://pubs.acs.org/doi/full/10.1021/acsnano.5c03978
- 最輕材料問世99.99%是空氣 硬度可調節 2015-12-11
- 山東大學崔基煒教授團隊AHM:低免疫原性靶向聚乙二醇納米粒子用于光熱-免疫協同治療 2025-01-08
- 山東大學崔基煒教授團隊AHM:凝聚體衍生的聚乙二醇納米顆粒用于聯合腫瘤治療 2025-01-08
- 復旦大學占昌友教授團隊:羥基PEG可規避人群預存抗PEG抗體 - 助力LNP高效遞送 2024-10-30
- 上科大葉春洪課題組 Nat. Commun.:超高等離子體手性光學信號的構筑及動態調控 2025-06-08
- 四川大學李建樹教授/謝婧副研究員、大連理工孫文研究員 AFM:一種具有pH響應性和軟骨滲透能力的超分子納米顆粒治療骨關節炎 2025-04-30
- 西北大學范代娣教授、朱晨輝教授、李陽副教授 AM:基于仿生凝血級聯途徑的多肽修飾脂質體納米顆粒可噴涂水凝膠治療不可壓破性創面出血 2025-04-19
