近日,合肥工業大學生物與醫學工程學院納米醫學和生物材料團隊一項研究發現,通過光熱試劑在近紅外光照射下所產生的光熱效應,能夠觸發化療藥物從粘流態高分子納米藥物載體中超敏釋放,顯著增強對腫瘤生長的抑制效果。該研究成果發表于國際材料學類期刊《先進功能材料》(DOI: 10.1002/adfm.201603195)。
高分子納米藥物載體在腫瘤治療領域具有廣泛的應用前景,第一代高分子納米藥物目前已經在多個國家進行臨床試驗。然而最新研究發現,高分子納米藥物富集在腫瘤部位并被腫瘤細胞攝取后,需要從納米載體中快速釋放才能達到更有效的腫瘤殺傷效果,目前臨床使用的聚乳酸體系高分子納米藥物無法實現這一需求。
該團隊開展的“近紅外光激發化療藥物從高分子納米載體可流動內核的超敏釋放效應”研究,在前期自主構建的疏水性聚磷酸酯納米體系基礎上,通過包載光熱試劑和化療藥物阿霉素得到共負載納米體系,其內核高分子材料玻璃化轉變溫度低至-81.8 °C。在近紅外光照射5秒后,納米顆粒溶液溫度微弱上升0.5~1.5°C,并觸發化療藥物的快超敏釋放。實驗結果表明,在腫瘤部位化療藥物富集基本相當的情況下,近紅外光觸發的化療藥物超敏釋放,能顯著增強抑制腫瘤生長。32天治療結束后,聚磷酸酯納米載體實驗組小鼠腫瘤體積僅為聚乳酸納米實驗組的三分之一。
對這兩種體系的熒光分子壽命檢測結果表明,在光熱效應下,觸發藥物分子和聚磷酸酯鏈段速度加劇,導致藥物快速釋放;近紅外光照射停止后,化療藥物的釋放速度極劇降低。而在目前臨床上使用的第一代聚乳酸高分子納米藥物中,由于聚乳酸的玻璃化轉變溫度高達40.2 °C,在光熱轉化時聚乳酸鏈段仍處于玻璃態,整個高分子鏈不能運動,從而導致化療藥物運動被阻止,這種超敏釋放效應并未觀察到。
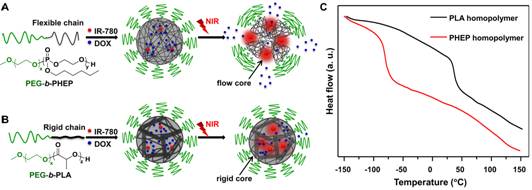
圖一、藥物從(A)聚磷酸酯和(B)聚乳酸納米顆粒的近紅外光超敏響應性釋放示意圖;(C)聚磷酸酯和聚乳酸的DSC曲線。
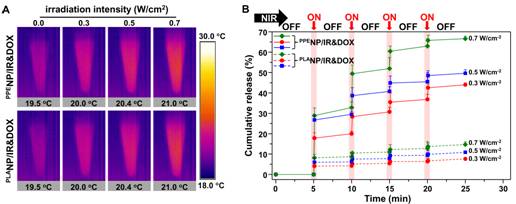
圖二、(A)共負載IR-780和DOX聚磷酸酯和聚乳酸納米顆粒的光熱效應;(B)近紅外光觸發DOX從聚磷酸酯和聚乳酸納米顆粒釋放行為。

圖三、(A)近紅外光照射下,DOX胞內聚磷酸酯和聚乳酸納米顆粒的釋放效應;(B)聚磷酸酯和聚乳酸納米顆粒載腫瘤組織的富集;(C)近紅外光照射下,共負載IR-780和DOX聚磷酸酯和聚乳酸納米顆粒對腫瘤生長的抑制曲線。
這一研究成果為抗腫瘤高分子納米藥物載體的設計提供了有價值的參考。該團隊還將進一步研發設計光調控的納米藥物載體,結合無機、脂質以及高分子等材料的研究,以期對腫瘤進行更有效的治療。
據介紹,該項成果的第一作者王俊俠是合肥工業大學生物與醫學工程學院的碩士研究生,在該院納米醫學和生物材料團隊以及中國科學技術大學實驗組完成。該同學一直從事聚磷酸酯納米體系用于腫瘤治療的研究工作。目前以共同第一作者在ACS Applied Materials Interfaces(IF 7.145)發表論文3篇,以第一作者身份在Advanced Functional Materials(IF 11.382)發表論文1篇。合肥工業生物與醫學工程學院納米醫學和生物材料團隊目前由錢海生教授、楊顯珠教授、查正保教授、王峰教授等人組成,團隊重點關注納米載體與細胞相互作用的調控、納米體系用于腫瘤的成像診斷、治療等方面的研究。
- 化學所劉國明研究員 PRL:高分子界面結晶新機制 - 介紹及一作解讀 2025-07-08
- 南科大楊燦輝團隊 Nat. Commun.:提出低遲滯強粘接高分子軟材料力學設計原理 2025-07-05
- 南京大學胡晶磊、胡文兵 PNAS:高分子與細胞膜相互作用的新規律 2025-07-05
- 四川大學何斌/蒲雨吉 ACS Nano:高分子化丁酸納米平臺治療腸炎 2023-12-24
- 華南理工朱偉 Adv. Sci.:基于紅細胞和MOF-級聯酶的人工生物雜化體用于高尿酸血癥治療 2023-12-17
- 長期有效 | 西南交大周紹兵教授團隊誠招博士、推免碩士 - 材料、生物醫學工程 2023-09-23
