靶向蛋白降解(TPD)技術(shù)因其高度特異性,近年來在腫瘤治療中備受關(guān)注。其中,疏水標(biāo)簽(HyT)作為新型TPD策略,通過引導(dǎo)熱休克蛋白HSP70識別靶蛋白實(shí)現(xiàn)降解,具備分子量更小、藥物利用度更高等優(yōu)勢。然而,由于HyT進(jìn)行蛋白降解需要在HSP70識別后發(fā)生,泛素化過程不能直接介導(dǎo)降解,導(dǎo)致HyT分子引起的蛋白降解效率有限。
低溫光熱治療(LTPTT)將組織加熱至41-45℃以實(shí)現(xiàn)對腫瘤細(xì)胞產(chǎn)生光熱損傷,可有效避免高溫帶來的正常組織損傷。然而LTPTT引起的HSP70的過表達(dá)提高了腫瘤細(xì)胞的熱損傷修復(fù)能力,阻礙了LTPTT的進(jìn)一步發(fā)展,導(dǎo)致其治療效果有限。
本研究提出將HyT與LTPTT相結(jié)合協(xié)同增強(qiáng)腫瘤治療。利用LTPTT誘導(dǎo)HSP70高表達(dá),而HyT“阻礙”HSP70的熱損傷修復(fù)功能,募集HSP70介導(dǎo)蛋白降解,從而增強(qiáng)TPD并提高LTPTT效果。基于此,研究團(tuán)隊(duì)構(gòu)建了以BRD4為靶點(diǎn)的HyT類降解劑JQ-HyT,并使用UCST型溫敏聚合物和聚多巴胺PDA包封JQ-HyT,開發(fā)了具備光熱響應(yīng)能力的功能化納米平臺JQ-NP@PDA。該平臺在近紅外激光808 nm照射下可實(shí)現(xiàn)局部升溫,促進(jìn)JQ-HyT釋放,以HSP70為媒介,實(shí)現(xiàn)TPD與LTPTT療效的協(xié)同增強(qiáng)。
小鼠皮下腫瘤實(shí)驗(yàn)顯示:該納米平臺顯著提升了抗腫瘤效果。該策略不僅推動了基于HyT 的蛋白質(zhì)降解劑的開發(fā),還提高了 LTPTT 的療效。本研究提出的聯(lián)合療法有望在癌癥治療中得到廣泛應(yīng)用。

2025年6月23日,相關(guān)成果“Synergistic Enhancement of Hydrophobic Tag with Low-Temperature Photothermal Technique for Cancer Therapy”發(fā)表于《Small》。天津工業(yè)大學(xué)為第一完成單位,天津工業(yè)大學(xué)高輝教授、馬飛賀研究員和余云健博士為共同通訊作者。本研究受到國家重點(diǎn)研發(fā)計(jì)劃項(xiàng)目、國家自然科學(xué)基金項(xiàng)目、天津市自然科學(xué)基金重點(diǎn)項(xiàng)目資助。
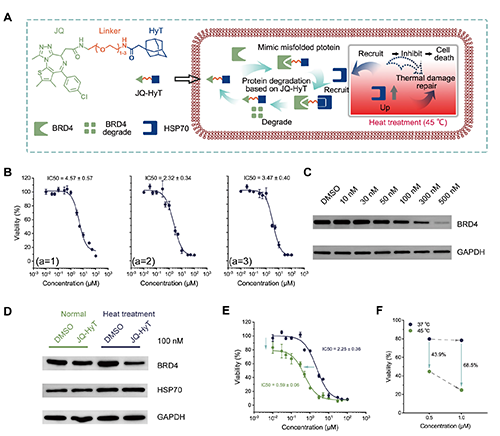
圖1. 熱處理與JQ-HyT聯(lián)合對BRD4降解及細(xì)胞毒性的影響。
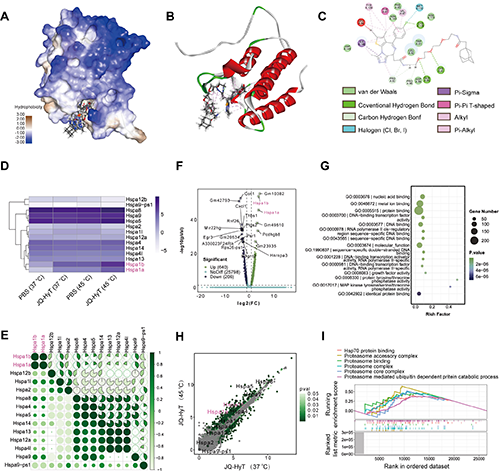
圖2. 熱處理與JQ-HyT聯(lián)合機(jī)理。
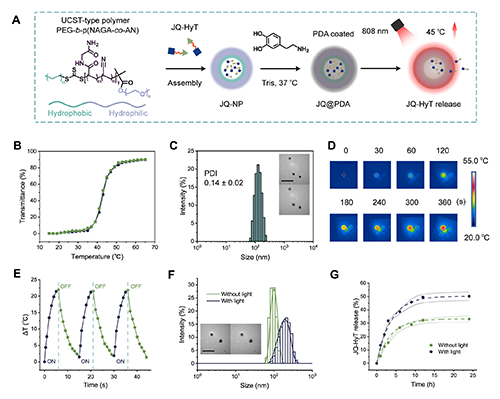
圖3. 功能化納米平臺JQ-NP@PDA的制備與表征。
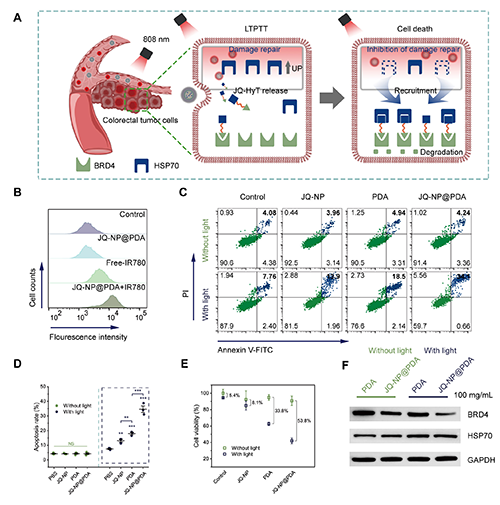
圖4. 使用JQ-NP@PDA進(jìn)行低溫光熱和BRD4蛋白降解協(xié)同治療的細(xì)胞水平研究。
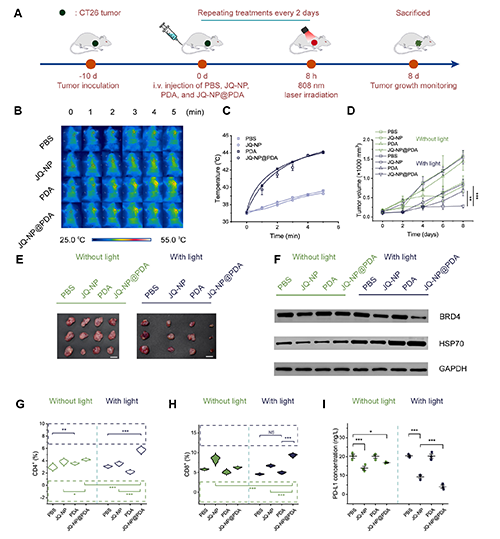
圖5. JQ-NP@PDA在小鼠模型中的抗腫瘤研究。
原文鏈接https://doi.org/10.1002/smll.202504000
- 天津科技大學(xué)劉亞青教授課題組Small:在低溫光熱殺菌領(lǐng)域取得新進(jìn)展 2021-10-28
- 常州大學(xué)王建浩教授團(tuán)隊(duì)《Acta Biomater.》:藥物儲庫型聚合物納米膠束用于腫瘤長效治療的研究成果 2025-07-08
- 中山大學(xué)吳丁財(cái)/黃榕康/鄭冰娜/王輝團(tuán)隊(duì) Adv. Mater.:具有長駐留性的可注射多孔炭納米酶水凝膠實(shí)現(xiàn)腫瘤的協(xié)同治療 2025-07-04
- 港中大(深圳)趙征 / 唐本忠團(tuán)隊(duì) ACS Nano :多功能AIE納米馬達(dá)突破腫瘤屏障 - 實(shí)現(xiàn)精準(zhǔn)光診療 2025-05-29
