數據顯示,全球每年約70萬人次死于超級細菌感染,大量地使用了抗生素,因細菌感染死亡的人數仍呈遞增狀態。更重要的是,抗生素濫用導致的細菌多藥耐藥性愈發普遍,已變成威脅未來人類健康的重大棘手問題。發展新型抗生素療法是對抗超級耐藥菌的重要策略之一,特別是新的殺菌機制,已成為開發治療感染新療法的新熱點。聚集誘導發光材料(AIEgen)因其背景熒光低、生物相容性好、光穩定性好被廣泛用于追蹤生物體和微生物體內生理活動及變化,在生物醫學檢測和分析中展示了極大的潛力。特別是結合AIEgen的光動力學活性,聚集誘導發光生物材料成為頗受關注的診療一體化材料。那么,是否可以將抗生素 (藥物殺菌)與診療一體AIE材料(熒光顯示和光動力治療),合三為一,從而構建多種殺菌機制互補的抗生素藥物,并且可通過熒光追蹤抗生素與細菌的作用機制,闡釋其治療機理進而指導新型療法的研發呢?
近日,香港科技大學唐本忠教授團隊與國家納米科學中心蔣興宇研究員和鄭文富研究員對這一可能性進行了探討。作者將具有AIE性能的三苯乙烯(TriPE)與抗菌功能的萘酰亞胺三唑(NT)相結合,成功制備了新型聚集誘導發光抗菌劑TriPE-NT。研究發現TriPE-NT具有典型的聚集誘導發光現象(圖一)。

圖一. TriPE-NT的結構和聚集誘導發光性能表征
(來源:Adv. Funct. Mater.)
光動力療法(PDT)利用光敏劑(PSs)吸收光并產生單線激發態(S1),S1態的能量可進一步轉移到三線激發態(T1),將周圍的三線態氧敏化,產生單線態氧或其他活性氧(ROS)。相比于傳統的光敏劑(卟啉等),AIEgen扭曲的分子結構可以避免π-π堆積導致的單線態氧淬滅,同時有扭曲分子內電荷轉移(TICT)特性的AIEgen已被證明能有效促進ROS的產生。作者通過ROS指示劑檢測到TriPE-NT在白光照射下可以產生ROS,并且指示劑的熒光強度在120 s增加70倍左右。由于AIEgen本身含有抗菌基團(NT),作者隨后檢驗TriPE-NT的殺菌效果和光動力產生的ROS是否可以疊加而增強殺菌效果。經TriPE-NT處理后,大腸桿菌(陰性菌,G-)、MDR大腸桿菌(G-)、肺炎克雷伯菌(G-)、MDR肺炎克雷伯菌(G-)、表皮葡萄球菌(陽性菌,G+)、MDR表皮葡萄球菌(G+)、金黃葡萄球菌(G+)和MDR金黃葡萄球菌(G+)在黑暗環境下存活率分別為約6.8%、14.1%、59.9%、74.4%、0%、0%、8.9%和22.4%;而在光照30分鐘后細菌的存活率分別約為0%、4%、10%、39%、0%、0%、2%和3%(圖二)。結果顯示,TriPE-NT本身具有殺菌功能且光照顯著增強了其殺菌能力。
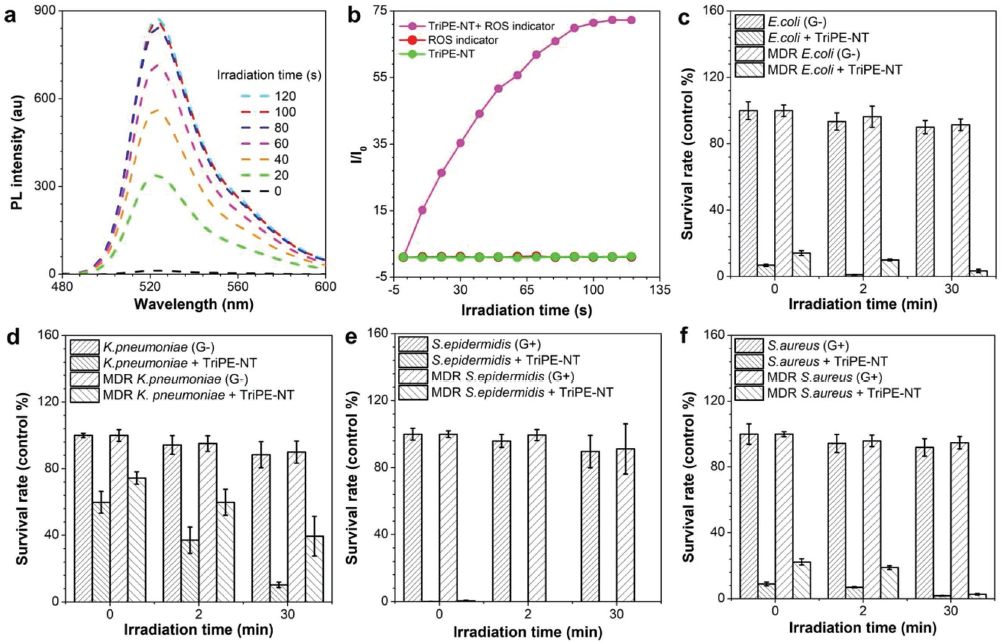
圖二. 光誘導ROS產生和TriPE-NT抗菌活性
(來源:Adv. Funct. Mater.)
作者隨后對TriPE-NT與細菌的相互作用進行研究。FMTM4-64FX(細菌膜)與TriPE-NT共染,研究發現在相同的染色時間內大腸桿菌(G-)染色量(粘附在表面或進入細菌內)明顯比表皮葡萄球菌(G+)少(圖三)。這可能是由于細菌表面帶負電荷,TriPE-NT表面帶正電荷,TriPE-NT容易與細菌相互作用。但由于陰性菌(G-)比陽性菌(G+)細胞壁多一層外膜,所以大腸桿菌(G-)進入量比表皮葡萄球菌(G+)少。

圖三. TriPE-NT與細菌相互作用明場和熒光成像
(來源:Adv. Funct. Mater.)
為了進一步驗證猜想,作者先用TriPE-NT處理陽性菌(表皮葡萄球菌、MDR表皮葡萄球菌、金黃葡萄球菌和MDR金黃葡萄球菌)和陰性菌(大腸桿菌、MDR大腸桿菌、肺炎克雷伯菌、MDR肺炎克雷伯菌),然后與碘化丙啶(PI,死細菌染色)共染。結果顯示在相同時間內TriPE-NT進入陽性菌(G+)的細菌數目比陰性菌(G-)多且較易殺死陽性菌(圖四),細菌殺死數量與細菌染色量呈一定的相關性。

圖四. 細菌染色和統計分析
(來源:Adv. Funct. Mater.)
為了進一步評價TriPE-NT的體內抗菌活性,作者將TriPE-NT作為抗菌噴劑進行大腸桿菌(G-)、MDR大腸桿菌(G-)、表皮葡萄球菌(G+)和MDR表皮葡萄球菌(G+)感染傷口的治療研究。結果顯示:第三天,經TriPE-NT處理的傷口比未經處理的傷口愈合快,且第七天區別更明顯;第七天,未經處理的大腸桿菌、MDR大腸桿菌、表皮葡萄球菌和MDR表皮葡萄球菌感染傷口愈合率約為16%、11%、34%和29%,而經過TriPE-NT處理后的傷口愈合率分別約為34%、28%、83%和65%。這表明,TriPE-NT可以治療細菌感染的傷口,且陽性菌感染的傷口比陰性菌感染的傷口愈合快一些。同時作者對材料進行了體外(CCK-8)和體內生物相容性(組織切片,HE染色)評價,結果證實TriPE-NT具有較好的生物相容性。
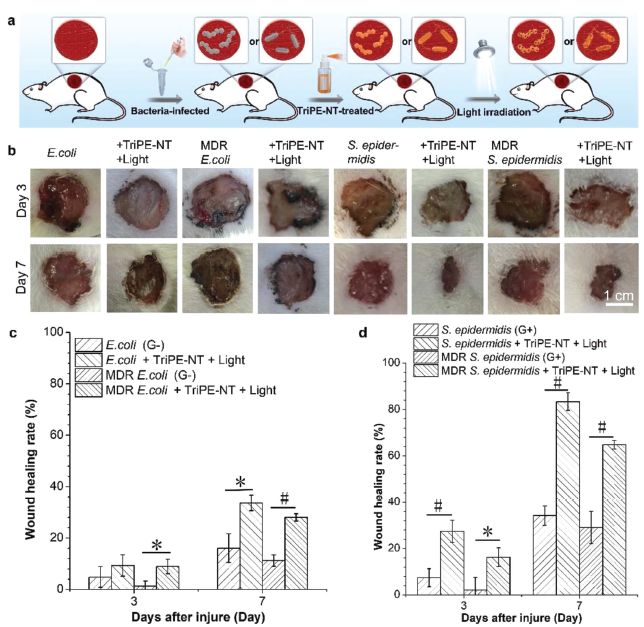
圖五. TriPE-NT治療細菌感染傷口
(來源:Adv. Funct. Mater.)
該工作開發了一種新型具有多功能的聚集誘導發光 (AIEgen)抗菌劑,三苯乙烯-萘酰亞胺三唑(TriPE-NT),用于監測藥物-細菌相互作用,并聯合光動力療法(PDT)殺滅細菌和增強抗菌能力(白光,ROS產生),能高效治療細菌感染的傷口。該藥物多功能設計在臨床實踐中具有綜合診療的潛力,且基于熒光的影像分析對藥物作用機理的闡述提供了有效手段。這些結果為接下來的抗多藥耐藥菌的研究提供了新思路。
這一成果近期發表在Adv. Funct. Mater.(DOI: 10.1002/adfm.201804632)上。該論文作者:Ying Li,# ZhengZhao,#(共同一作)Jiangjiang Zhang, Ryan T. K. Kwok, Sheng Xie, Rongbing Tang,Yuexiao Jia, Junchuan Yang, Le Wang, Jacky W. Y. Lam, Wenfu Zheng,* XingyuJiang,* Ben Zhong Tang*。
- 港中大(深圳)趙征 / 唐本忠團隊 ACS Nano :多功能AIE納米馬達突破腫瘤屏障 - 實現精準光診療 2025-05-29
- 港中文(深圳)唐本忠院士、深圳大學王東教授等 Nat. Protoc.: NIR-II激發AIE仿生納米用于肺結核活體光學診療 2025-04-18
- 香港中文大學(深圳)唐本忠院士團隊 AFM:自上而下法制備AIE/柔性木基傷口敷料 - 助力耐藥菌感染傷口快速愈合 2025-02-13
- 香港中文大學(深圳)唐本忠院士/趙征教授團隊《ACS Nano》:細胞膜靶向的聚集誘導發光分子用于神經追蹤和損傷的可視化 2025-01-21
- 香港中文大學(深圳)唐本忠院士與趙征教授團隊《ACS Nano》綜述:聚集誘導發光材料實現高分辨生物成像 2025-01-07
- 港中深唐本忠院士/北理工黎朝 AM:基于AIE活性納米復合水凝膠的可穿戴交互式信息-傳感材料 2024-03-23
