自組裝高分子膠束作為多功能藥物載體受到廣泛關注。已有多種基于聚合物膠束的納米給藥系統被FDA批準或進入臨床試驗,但是它們的治療效果并未達到預期。主要原因之一在于高分子自組裝體固有的動態結構和不穩定性使其難以承受體內的高倍稀釋及與血液成分的相互作用,進而導致藥物的泄露和非特異性組織分布。盡管物理或化學交聯能有效增強高分子自組裝結構的穩定性,但同時會影響納米系統的響應能力,降低藥物在病灶的釋放效率。因此,聚合物膠束的穩定性和響應性仍是目前亟需解決的矛盾問題。
近日,四川大學高分子科學與工程學院丁明明和譚鴻教授提出一種交聯誘導再組裝(CIRA)策略,利用界面點擊交聯驅動多嵌段聚合物發生微相分離,使聚合物膠束內核中的刺激敏感鍵遷移到膠束界面,從而同時提高聚合物載體的動力學和熱力學穩定性以及還原響應性,實現靈敏的釋藥開關,解決高分子自組裝體穩定和釋放的矛盾問題(圖1)。
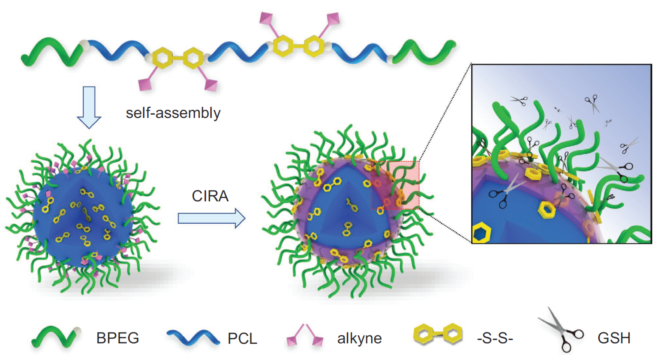
圖1. 交聯誘導再組裝(CIRA)策略示意圖
為了實現該策略,研究團隊在前期工作(Biomaterials 2017, 145, 138-153)的基礎之上設計并構筑可點擊多嵌段聚氨酯(MPU)膠束,并使用一種可還原斷裂的交聯劑(SS-Az)進行界面點擊交聯。利用光散射、熒光光譜、二維核磁和傅里葉變換紅外光譜等方法表征了自組裝體的高級結構、穩定性和刺激響應性,闡明了CIRA驅動自組裝體微相分離的機理(圖2)。
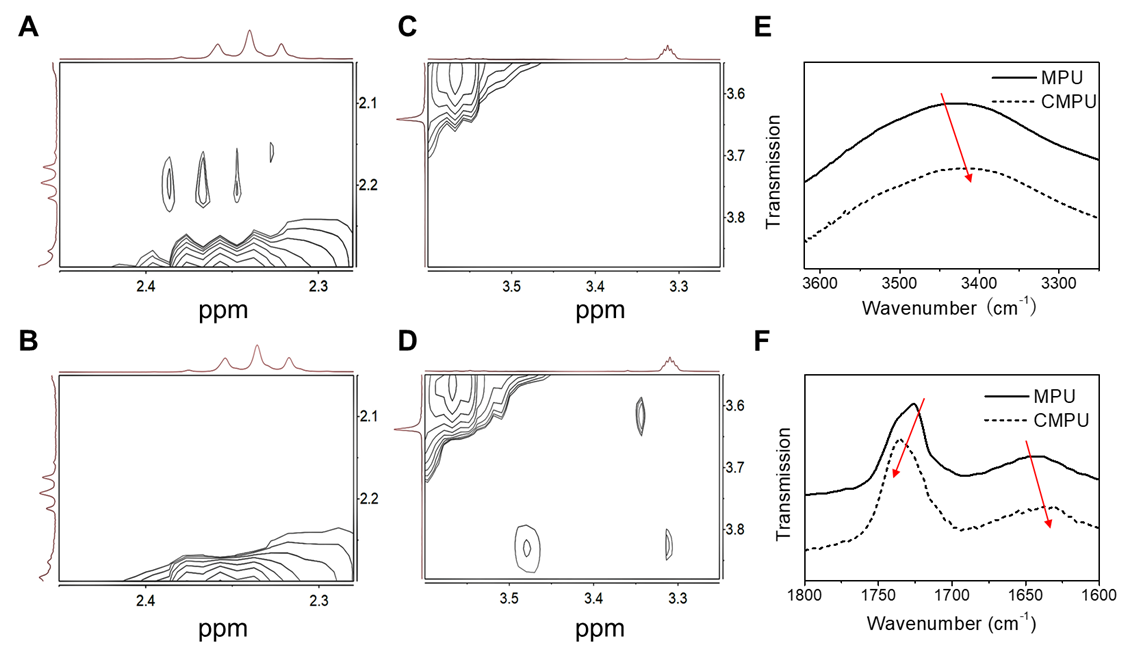
圖2.交聯驅動自組裝體微相分離機制研究
進一步研究CIRA對于高分子納米材料生物學性能的影響,以抗腫瘤應用為模型,發現CIRA功能化的膠束能夠顯著提高納米系統的穩定性,實現靈敏的藥物控釋開關,從而延長藥物循環時間,改善藥物組織分布,在體內外實現良好的抗腫瘤效果(圖3)。該工作為高分子自組裝行為提供了新的理解,并為多功能納米藥物載體的設計提供新思路。

圖3. CIRA功能化聚合物自組裝體的細胞內藥物傳遞和組織分布
以上相關成果發表于Advanced Science(DOI:10.1002/advs.201902701)。論文第一作者為四川大學碩士研究生楊瑞和鄭毅,共同通訊作者為丁明明教授和譚鴻教授。該項研究工作得到國家自然科學基金(51873118,21474064,51203101)、國家杰出青年科學基金(51425305)和高分子國家重點實驗室項目的資助。
論文連接: https://onlinelibrary.wiley.com/doi/full/10.1002/advs.201902701
- 中國科大陳昶樂/安大陳敏、張文建 Angew:ROMP-RAFT串聯聚合新方法制備聚烯烴多嵌段共聚物 2025-07-02
- 天津大學/北京大學 Sci. Adv.:基于光子微球索引的高容量DNA數據存儲隨機訪問技術 2025-06-21
- 青科大李志波/劉紹峰教授團隊 ACS Catal.: 新型鉿金屬催化劑鏈穿梭聚合制備高熔點烯烴嵌段共聚物OBC 2025-05-11
- 中國科大龔興龍課題組、伍倫貢大學李衛華課題組 Adv. Mater.:剪切變硬膠基異質自組裝策略實現極端環境下力-熱耦合多場防護 2025-07-09
- 天津大學宋東坡教授課題組 Angew:超分子瓶刷自組裝構筑納米到微米跨尺度光學結構 2025-05-15
- 東北林業大學劉守新教授團隊 Small:乙醇介導的膠束自組裝實現具有單晶形態和可調孔結構的有序介孔炭 2025-05-02
