高性能遞送載體的構(gòu)建已成為化學(xué)、材料學(xué)、生物學(xué)、醫(yī)學(xué)等多學(xué)科綜合交叉領(lǐng)域的前沿和熱點。為了解決傳統(tǒng)化療常常“敵我不分”,治療效率低下且毒副作用明顯的問題,多模式治療的概念被提出并受到廣泛關(guān)注。近年來,科學(xué)工作者利用陽離子遞送載體的可設(shè)計性、可修飾性,將有機光敏劑、光熱試劑、放\化療藥物等功能物質(zhì)引入到陽離子核酸遞送系統(tǒng)中,以實現(xiàn)對靶細(xì)胞的多模式治療。體內(nèi)外實驗結(jié)果表明這種多模式治療系統(tǒng)具有優(yōu)良的效果,但同時也存在著制備過程中,為了實現(xiàn)構(gòu)建多功能遞送載體的目標(biāo),需要通過復(fù)雜的物理、化學(xué)方法對遞送載體進行修飾。遞送載體在引入這些疏水功能分子以后不可避免的改變自身理化性質(zhì)。是否能夠設(shè)計可以同時表達(dá)多種光熱、光敏或基因編輯蛋白的新型功能質(zhì)粒,通過遞送載體導(dǎo)入靶細(xì)胞后,在同一個靶細(xì)胞表達(dá)多個功能蛋白實現(xiàn)基因的多模式治療是本研究的出發(fā)點。
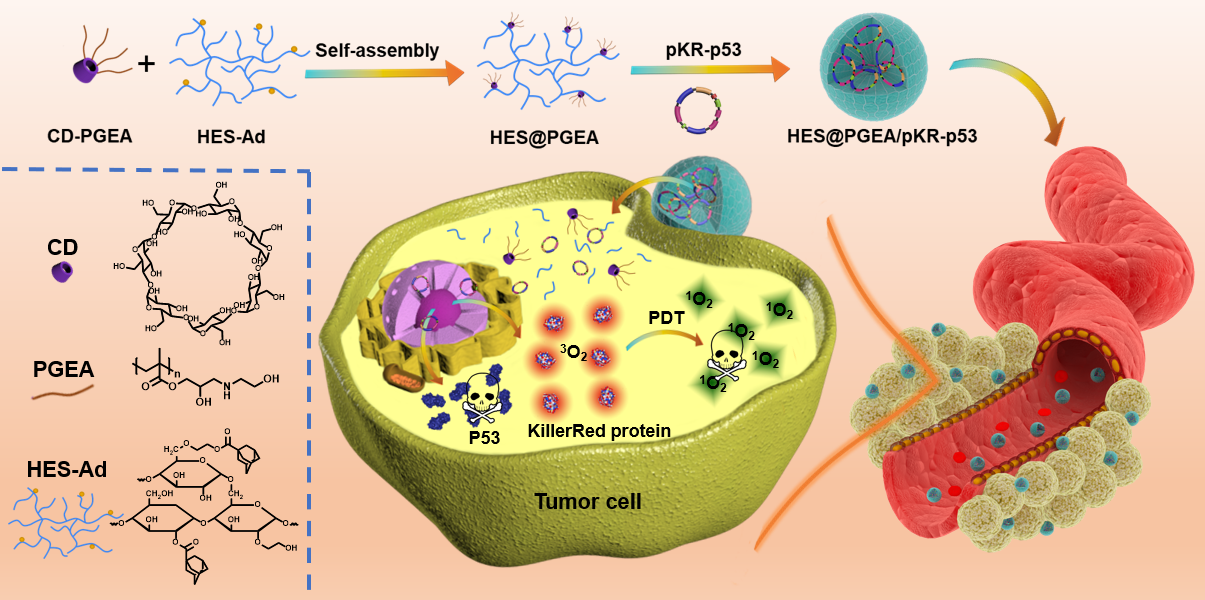
圖1. 超分子核酸納米遞送系統(tǒng)的構(gòu)建及腫瘤多模式治療過程
如圖1所示,徐福建教授團隊以金剛烷修飾的羥乙基淀粉(HES-Ad)和乙醇胺功能化的β-環(huán)糊精基聚甲基丙烯酸縮水甘油酯(CD-PGEA)為出發(fā)點,通過超分子組裝的方式得到新型多糖基陽離子遞送載體(HES@PGEA)。該載體通過攜帶自行設(shè)計的可分別表達(dá)光敏蛋白(KillerRed,KR)和腫瘤抑制蛋白(P53)的質(zhì)粒(pKR-p53)進入腫瘤,實現(xiàn)基因調(diào)控下的細(xì)胞凋亡/光動力殺傷的雙模式治療。
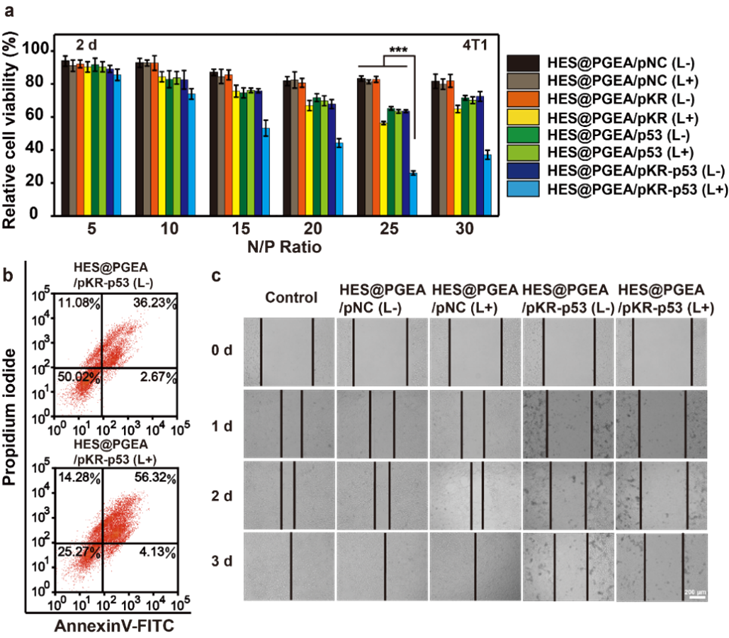
圖2. 體外腫瘤細(xì)胞抑制實驗的相關(guān)結(jié)果
通過體外腫瘤細(xì)胞抑制實驗的相關(guān)數(shù)據(jù)可以得知(圖2),相比于單獨遞送p53抑瘤基因和單獨遞送pKR基因并進行光動力治療的治療效果,本研究所構(gòu)建的“pKR-p53”一體化質(zhì)粒能夠在載體的攜帶下在同一細(xì)胞中同時表達(dá)兩種蛋白達(dá)到協(xié)同的抑瘤效果。
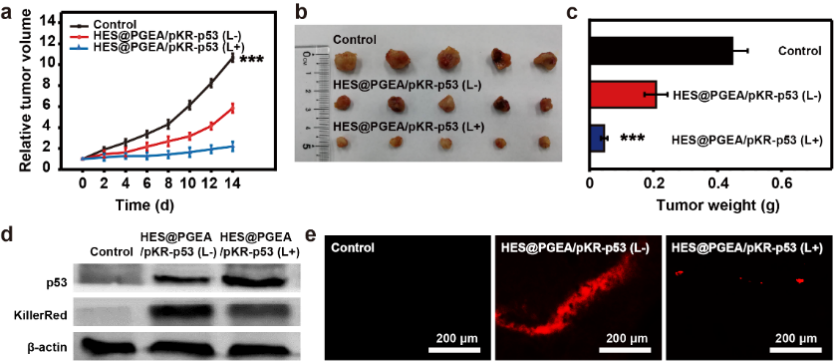
圖3. 體內(nèi)抑瘤實驗的相關(guān)結(jié)果
研究團隊進一步在荷瘤小鼠體內(nèi)驗證了這種基因多模式治療策略的可行性。如圖3所示,利用所構(gòu)建的高效HES@PGEA載體可以成功遞送pKR-p53質(zhì)粒進入腫瘤組織細(xì)胞,表達(dá)兩種相關(guān)蛋白。在光照調(diào)控下,該雙模式治療策略取得了良好的抑瘤效果。這種基因多模式治療系統(tǒng)的提出為腫瘤以及其他疾病的治療提供了新的治療策略和思路。
以上相關(guān)成果以“Genetically multimodal therapy mediated by one polysaccharides-based supramolecular nanosystem”為題發(fā)表在Biomaterials上。論文的第一作者為北京化工大學(xué)材料科學(xué)與工程學(xué)院的許晨博士和碩士研究生胡文婷,通訊作者為徐福建教授和俞丙然副教授。
論文鏈接:https://doi.org/10.1016/j.biomaterials.2020.120031
- 中科大王育才/李敏團隊 Nat. Biomed. Eng.: 設(shè)計低免疫原性mRNA遞送載體在體內(nèi)重編程耐受性APC 2025-04-01
- 天津大學(xué)史志遠(yuǎn)教授團隊招聘科研助理 - 高分子化學(xué)、微凝膠/微囊泡/脂質(zhì)體、酶包裹遞送載體、微流控 2024-12-17
- 天津大學(xué)史志遠(yuǎn)教授團隊招聘科研助理 - 高分子化學(xué)、微凝膠/微囊泡/脂質(zhì)體、酶包裹遞送載體、人造細(xì)胞、微流控 2024-10-14
- 二十余載深耕|北京大學(xué)范星河教授編著新書《聚合物鏈超分子組裝與功能化: 甲殼型液晶聚合物》出版 2025-01-14
- 同濟大學(xué)劉國鋒、南洋理工大學(xué)趙彥利院士 Nat. Commun.:超分子組裝體的動態(tài)手性反轉(zhuǎn) 2024-11-14
- 陜科大王學(xué)川、劉新華、岳歐陽等 Nano Today:基于超分子相互作用的形狀適應(yīng)水下粘合材料 2024-04-24
- 天工大高輝/馬飛賀/余云健 Small:疏水標(biāo)簽/低溫光熱協(xié)同增強腫瘤治療 2025-07-11
