癌癥疫苗通過(guò)激活人體自身的免疫系統(tǒng)來(lái)消除腫瘤,已經(jīng)成為最有前途的癌癥治療策略之一。然而,目前大多數(shù)已獲許可的疫苗只能誘導(dǎo)CD4+ T細(xì)胞介導(dǎo)的體液免疫,而不能誘導(dǎo)CD8+ T細(xì)胞調(diào)節(jié)的細(xì)胞免疫,對(duì)癌癥患者的治療效果有限,臨床效益不理想。熱休克蛋白(HSPs)是生物體內(nèi)最豐富、最普遍的分子伴侶之一,它不僅是復(fù)雜蛋白穩(wěn)態(tài)的有效調(diào)節(jié)因子,而且是免疫系統(tǒng)強(qiáng)有力的激活因子。HSPs可以通過(guò)其獨(dú)特的蛋白結(jié)合域捕獲腫瘤抗原,形成穩(wěn)定的HSP-抗原復(fù)合物。隨后,HSP通過(guò)與抗原提呈細(xì)胞(APCs)表面受體的相互作用被順利內(nèi)化,并通過(guò)MHC I和MHC II途徑呈遞抗原,從而激活細(xì)胞毒性T細(xì)胞(CD8+)和T輔助細(xì)胞(CD4+),發(fā)揮其免疫功能。
近日,南開大學(xué)化學(xué)學(xué)院史林啟教授團(tuán)隊(duì)聯(lián)合中國(guó)醫(yī)學(xué)科學(xué)院放射醫(yī)學(xué)研究所劉鑒峰研究員團(tuán)隊(duì)在國(guó)際知名學(xué)術(shù)期刊Nano Letters(DOI: 10.1021/acs.nanolett.0c01230)上發(fā)表文章。該研究利用表面修飾甘露糖的混合殼層膠束模擬熱休克蛋白的結(jié)構(gòu)和功能,構(gòu)建了一種新型的納米分子伴侶(nChap)作為納米疫苗用于激活抗腫瘤免疫反應(yīng)。nChap的表面由塌縮的pH響應(yīng)性疏水微區(qū)與伸展的親水聚合物鏈段組成,從而形成類似熱休克蛋白的疏水結(jié)合域和空腔,可以捕獲抗原并通過(guò)受體介導(dǎo)作用將其靶向遞送至樹突狀細(xì)胞(DCs)。隨后,nChap借助疏水微區(qū)在酸性條件下的質(zhì)子海綿效應(yīng)破壞溶酶體,從而促進(jìn)抗原逃逸并增強(qiáng)其在細(xì)胞質(zhì)中的交叉遞呈,進(jìn)而同時(shí)誘導(dǎo)基于CD4+和CD8+ T細(xì)胞的免疫反應(yīng),從而實(shí)現(xiàn)對(duì)腫瘤細(xì)胞的高效殺傷(圖1)。

圖1. 基于納米分子伴侶的癌癥疫苗用于癌癥免疫療法的原理圖。
研究人員首先以雞卵清蛋白(OVA)為抗原模型,研究nChap對(duì)OVA的捕獲能力。動(dòng)態(tài)光散射(DLS)和熒光共振能量轉(zhuǎn)移實(shí)驗(yàn)(FRET)結(jié)果均表明nChap通過(guò)疏水微區(qū)可成功捕獲OVA形成納米分子伴侶-OVA復(fù)合物(nChap@OVA)(圖2b-d)。同時(shí),nChap@OVA在不同pH條件下的粒徑變化以及在體外OVA的累計(jì)釋放結(jié)果均顯示nChap具有可逆捕捉/釋放OVA的能力(圖2e-f)。

圖2. (a) nChap@OVA納米疫苗制備示意圖, (b, c) PMs和nChap在不同濃度的OVA下的尺寸分布變化, (d) 熒光共振轉(zhuǎn)移圖, (e) nChap捕獲/釋放OVA后粒徑的分布, (f) nChap@OVA體外累積釋放曲線, (g) PAE鏈的質(zhì)子化/去質(zhì)子化以實(shí)現(xiàn)其親水/疏水轉(zhuǎn)化的示意圖
接下來(lái),研究人員考察了納米分子伴侶疫苗的細(xì)胞內(nèi)化,促進(jìn)抗原溶酶體逃逸以及誘導(dǎo)骨髓源樹突狀細(xì)胞(BMDCs)成熟的能力。激光共聚焦和流式細(xì)胞術(shù)的結(jié)果表示,甘露糖修飾的納米疫苗可以促進(jìn)DC細(xì)胞對(duì)其的攝取(圖3a-c)。進(jìn)一步共定位實(shí)驗(yàn)發(fā)現(xiàn),當(dāng)進(jìn)入溶酶體酸性環(huán)境后,納米分子伴侶的疏水微區(qū)鏈段會(huì)通過(guò)質(zhì)子海綿效應(yīng)促進(jìn)溶酶體的破裂,從而實(shí)現(xiàn)抗原的胞質(zhì)遞送(圖3d-f)。同時(shí),納米分子伴侶疫苗成功激活了BMDCs,上調(diào)了BMDCs表面多種成熟信號(hào)(圖3g-j)。

圖3. (a,b,c)細(xì)胞攝取的激光共聚焦圖像和流式細(xì)胞術(shù)檢測(cè)及統(tǒng)計(jì)數(shù)據(jù), (d)nChap輔助OVA溶酶體逃逸, (e)皮爾遜相關(guān)系數(shù)分析, (f)甘露糖介導(dǎo)nChap@OVA被DC細(xì)胞內(nèi)化以及PAE的質(zhì)子海綿效應(yīng)促進(jìn)抗原溶酶體逃逸示意圖, (g-j)BMDCs表面成熟信號(hào)的表達(dá)
研究人員還考察了納米分子伴侶作為預(yù)防性疫苗在小鼠體內(nèi)的抑瘤效果。實(shí)驗(yàn)結(jié)果表明納米伴侶疫苗可有效抑制黑色素瘤的生長(zhǎng)并延長(zhǎng)了小鼠的生存周期(圖4b-c)。此外,經(jīng)nChap@OVA免疫后的小鼠脾臟中CD8+T細(xì)胞的百分比明顯增加,并且當(dāng)脾細(xì)胞被抗原重新刺激之后,OVA特異性的CD8+ T細(xì)胞迅速增殖(圖4e-i)。值得注意的是,這些CD8+ T細(xì)胞可選擇性的直接殺傷B16F10-OVA黑色素瘤(圖4j)。此外, nChap@OVA組小鼠血清中腫瘤壞死因子-α (TNF-α)和干擾素-γ (IFN-γ)都明顯上調(diào)(圖4k-l)。以上結(jié)果證明nChap@OVA納米疫苗能誘導(dǎo)強(qiáng)烈的免疫反應(yīng),并且特異性地清除腫瘤。
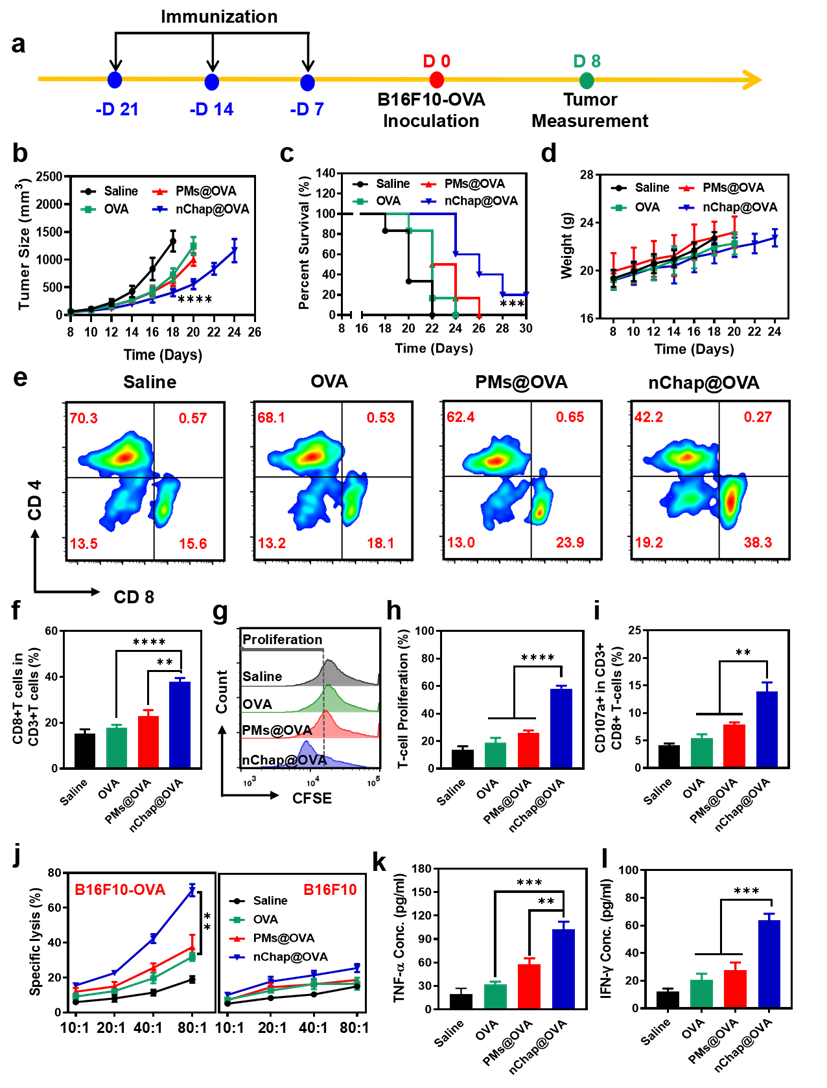
圖4. (a)免疫預(yù)防組實(shí)驗(yàn)方案, (b)荷瘤小鼠的平均腫瘤生長(zhǎng)曲線, (c)各組小鼠的生存曲線, (d)各組小鼠體重變化, (e, f)免疫后小鼠脾臟中CD8+ T細(xì)胞和CD4+ T細(xì)胞含量, (g, h)脾臟細(xì)胞中T細(xì)胞的增殖情況, (i)脾臟細(xì)胞中CD3+CD8+CD107+ T細(xì)胞的含量, (j)CD8+ T細(xì)胞對(duì)腫瘤的特異性殺傷能力, (k, l)免疫小鼠血清中TNF-α和IFN-γ的含量
除此之外,研究人員進(jìn)一步評(píng)估了基于nChap的納米疫苗與anti-PD-1檢查點(diǎn)阻斷的聯(lián)合治療效果。結(jié)果顯示,單純使用anti-PD-1或nChap@OVA 納米疫苗僅能稍微延緩腫瘤的生長(zhǎng),在28-32天內(nèi)全部小鼠死亡。而聯(lián)合治療能有效抑制腫瘤生長(zhǎng),延長(zhǎng)小鼠生存時(shí)間至50天以上(圖5 b-c)。究其原因是,納米分子伴侶疫苗可以同時(shí)激活CD4+ T細(xì)胞和CD8+ T細(xì)胞,并促進(jìn)它們?cè)谀[瘤中的積累。而anti-PD-1抗體能有效減少腫瘤細(xì)胞對(duì)T細(xì)胞的耗竭,進(jìn)一步增強(qiáng)T細(xì)胞向腫瘤的浸潤(rùn),從而在聯(lián)合免疫治療中實(shí)現(xiàn)協(xié)同抗腫瘤反應(yīng)(圖5 e-i)。
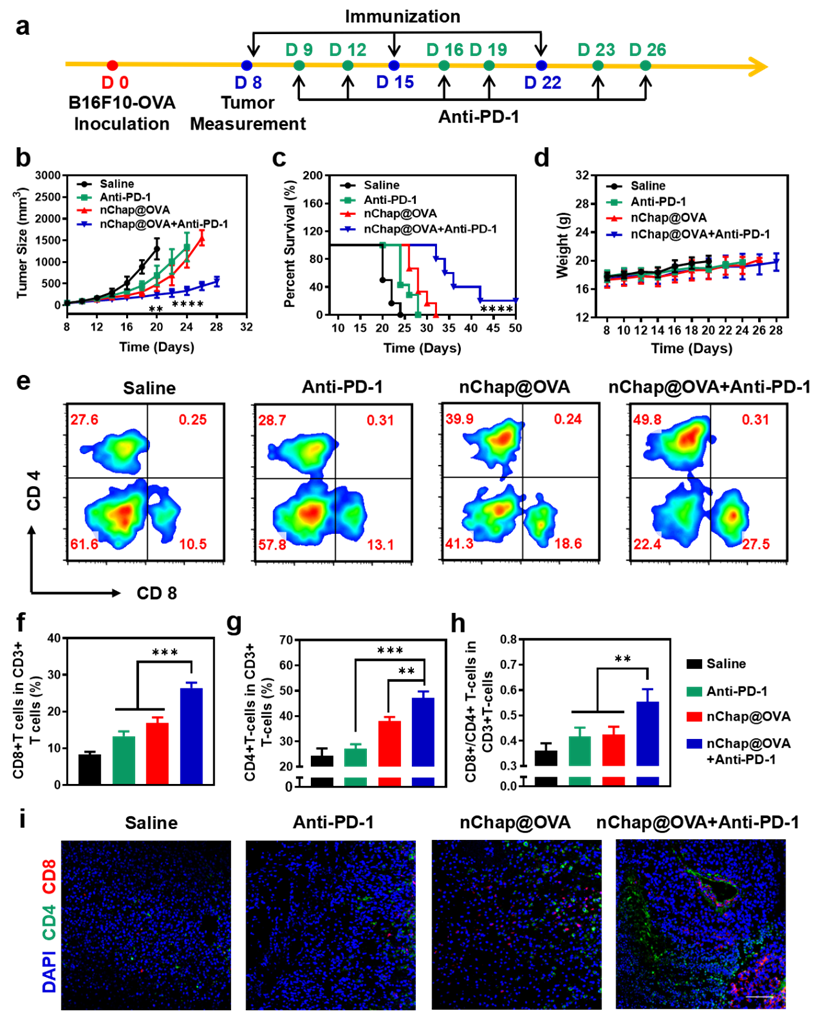
圖5. (a)針對(duì)已建立B16F10-OVA腫瘤的小鼠的免疫治療方案, (b)各組小鼠腫瘤生長(zhǎng)曲線, (c)各組小鼠的生存曲線, (d)各組小鼠體重變化曲線, (e-h)各組小鼠腫瘤中CD8+ T細(xì)胞和CD4+ T細(xì)胞的數(shù)量以及兩者的比值, (i)腫瘤切片免疫熒光染色
以上體外/體內(nèi)實(shí)驗(yàn)結(jié)果均表明,這種基于納米分子伴侶的疫苗可以有效地模仿HSPs的結(jié)構(gòu)和功能,實(shí)現(xiàn)疏水微區(qū)結(jié)構(gòu)輔助的抗原捕獲、表面受體介導(dǎo)的DCs內(nèi)化以及對(duì)體液免疫和細(xì)胞免疫的雙重激活,有望為開發(fā)高效的仿生納米疫苗提供新的策略與思路。
論文的第一作者為南開大學(xué)化學(xué)學(xué)院李雪博士。南開大學(xué)化學(xué)學(xué)院史林啟教授,劉陽(yáng)研究員和中國(guó)醫(yī)學(xué)科學(xué)院放射醫(yī)學(xué)研究所劉鑒峰研究員、黃帆副研究員為論文的共同通訊作者。
論文鏈接:https://pubs.acs.org/doi/10.1021/acs.nanolett.0c01230
- 南開史林啟、天工大馬飛賀《Small Methods》:Holdase/Foldase模擬納米分子伴侶改善基于抗體的癌癥免疫療法 2022-10-19
- 南開大學(xué)史林啟教授、馬如江副研究員團(tuán)隊(duì):納米分子伴侶調(diào)控胰島素的遞送 2020-02-25
- 新型納米分子伴侶重塑β-淀粉樣蛋白穩(wěn)態(tài)用于阿爾茲海默癥的預(yù)防性治療 2019-09-29
- 東華大學(xué)沈明武/史向陽(yáng)團(tuán)隊(duì) Bioact. Mater.:基于納米凝膠的治療型納米疫苗通過(guò)全周期免疫調(diào)節(jié)實(shí)現(xiàn)腫瘤的預(yù)防及直接治療 2024-09-25
- 清華大學(xué)杜娟娟/軍事醫(yī)學(xué)研究院楊益隆合作團(tuán)隊(duì) ACS Nano:一種激活兩條天然免疫途徑的無(wú)佐劑納米疫苗 2024-03-19
- 上海交大劉盡堯團(tuán)隊(duì) Small:雙抗原展示納米疫苗 2023-12-08
- 溫醫(yī)大紀(jì)建松/蘇大劉莊、馮良珠 Adv. Sci.:腫瘤碎片驅(qū)動(dòng)的膽固醇靶向催化水凝膠可增強(qiáng)微波消融聯(lián)合抗腫瘤免疫反應(yīng)療效 2024-12-16
