目前,良性前列腺增生、惡性腫瘤和動靜脈畸形等疾病嚴重危害人類的生命健康。傳統的藥物治療和外科手術治療所帶來的副作用和創傷限制了它們在臨床上的廣泛使用。經導管動脈栓塞術(TAE)具有創傷小、簡便、安全、療效高和并發癥少等多種優勢,受到人們的廣泛關注。傳統的栓塞材料在臨床使用過程中存在功能單一、藥物釋放快、缺乏X光顯影性及栓塞劑返流等問題。因此,開發新型多功能栓塞材料成為TAE領域研究的熱點。
近日,華中科技大學生命學院楊光教授團隊在生物材料高水平期刊Bioactive Materials上發表了題為“Immobilized thrombin on X-ray radiopaque polyvinyl alcohol/chitosan embolic microspheres for precise localization and topical blood coagulation”的研究論文,該期刊的最新即時影響因子為13.07。
臨床使用的栓塞劑絕大部分缺乏X光顯影性,介入醫師通常需要通過將栓塞材料與碘造影劑(如碘海醇、優維顯等)物理混合然后注入到靶動脈。然而,這種方法存在幾個方面的缺陷:首先,造影劑容易與栓塞劑分離,導致成像模糊或誤診;第二,造影劑的快速擴散導致TAE術后復查困難;第三,碘造影劑具有一定的腎毒性而且可能會引起一些患有甲狀腺疾病的患者發生不良反應。栓塞過程中存在的另一個挑戰是栓塞材料的返流現象,即栓塞材料進入血管后因為推注速度過快或注入過程中血流速度減慢等原因沿著與注入方向相反的方向流入其它動脈或導管。這種現象可能會導致嚴重的問題,包括非靶向性栓塞、導管夾閉,甚至治療失敗。

圖1 兼具X光顯影性和局部促凝血活性的凝血酶@BaSO4/PVA/CS微球用于動脈栓塞的示意圖。
基于以上問題,研究團隊開發一種同時負載凝血酶和BaSO4納米顆粒的多功能栓塞微球,這種栓塞材料兼具X光顯影性和局部促凝血的功能,能夠實現栓塞過程中精準定位和避免栓塞劑的返流(圖1)。該研究通過共沉淀法合成了BaSO4納米顆粒作為X光顯影劑,將其負載到聚乙烯醇/殼聚糖(PVA/CS)聚合物基質后制備成BaSO4/PVA/CS微球,然后將凝血酶共價負載到微球表面以實現微球的生物功能化。體外凝血動力學實驗、全血凝集實驗、血細胞粘附及血纖維蛋白誘導生成實驗證實了凝血酶@BaSO4/PVA/CS微球具有較好的促凝血活性(圖2)。此外,BaSO4/PVA/CS微球在X光下具有良好的顯影性,隨著BaSO4納米顆粒負載量的增加,X光顯影性能逐漸增強。兔耳中央動脈栓塞的實驗結果表明了BaSO4/PVA/CS微球在體內具有長時間顯影穩定性。此外,BaSO4/PVA/CS 和凝血酶@BaSO4/PVA/CS微球栓塞均能引起兔耳組織出現缺血壞死,且隨著栓塞時間延長組織壞死情況更加嚴重(圖3)。

圖2 凝血酶@BaSO4/PVA/CS微球促凝血活性分析。A. 全血凝集動力學曲線。B. 全血在微球表面凝集測試。C. 血纖維蛋白誘導生成測試。
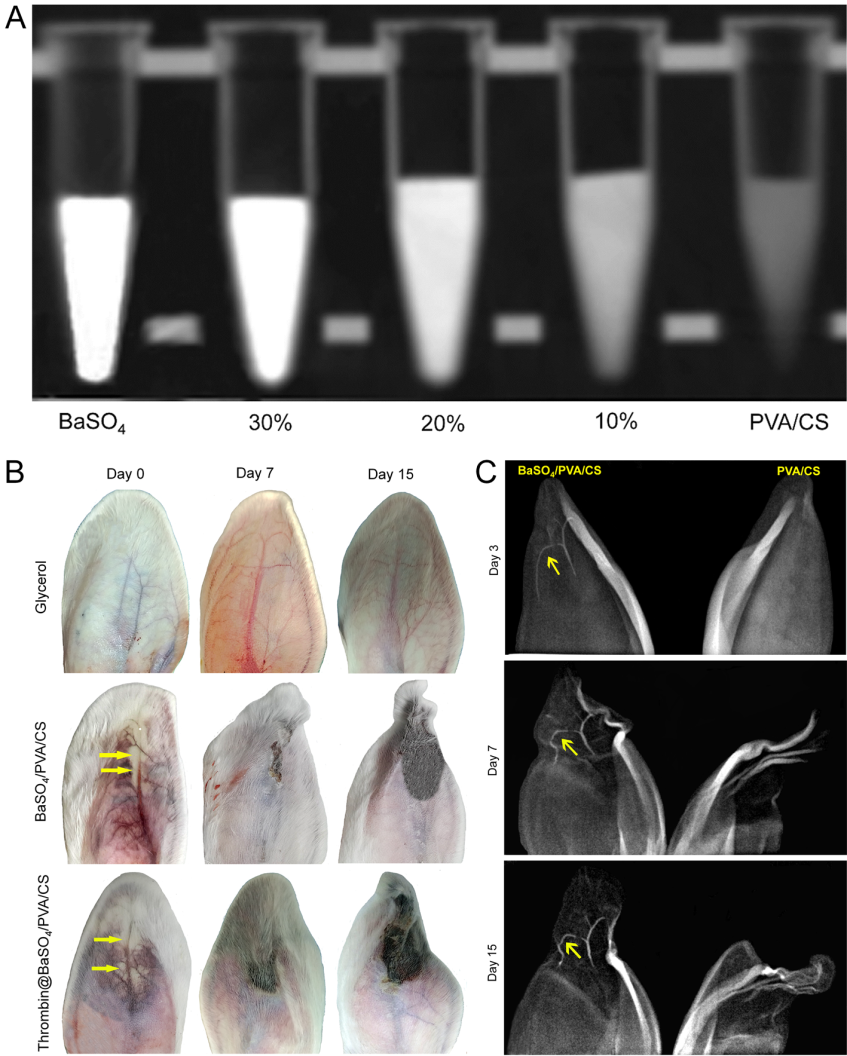
圖3 A. 體外X光顯影測試。B. 兔耳栓塞不同階段形態變化分析。C. 微球體內X光顯影分析。
華中科技大學生命科學與技術學院的楊光教授、華中科技大學同濟醫學院附屬同濟醫院的肖駿教授以及中山大學生物醫學工程學院的肖林博士為本論文的共同通訊作者,華中科技大學生命學院15級博士李曉宏為該論文第一作者。廣東省人民醫院骨科紀雄發博士后、華中科技大學同濟醫學院附屬同濟醫院的博士李拔森等參與了該研究工作。研究工作得到了國家自然科學基金和國家重點研發計劃等項目的資助。
論文鏈接:https://www.sciencedirect.com/science/article/pii/S2452199X20303388
在另一項研究工作中,該團隊制備了一種具有離子交換性能的多孔PVA微球作為化療栓塞的栓塞劑。首先通過反相乳化法結合熱誘導相分離(TIPS)技術制備了多孔PVA(PPVA)微球,該微球球形規整,表面為“蜂窩狀”多孔結構,通過淬火溫度的改變可以有效調節微球的孔徑(圖4)。將對苯乙烯磺酸鈉(SSS)單體在PPVA微球上接枝聚合,得到的PPVA-g-PSSS微球上具有帶負電荷的磺酸根基團,因而可以通過離子交換機制將帶正電荷的DOX有效地負載到接枝的 PPVA-g-PSSS微球中, 這種載藥微球在體外具有長時間藥物緩釋性能(圖5)。

圖4 A. 反相乳化法結合TIPS技術制備PPVA微球的示意圖。B. 在不同淬火溫度下制備的PPVA微球的FESEM圖:(a1, a2)-196 oC, (b1, b2)-80 oC, (c1, c2)-23 oC, (d1, d2)-15 oC。

圖5 A. 接枝聚合法制備PPVA-g-PSSS微球及通過離子交換交換機制負載DOX的示意圖。B. 每10 μm為間隔拍攝的DOX@PPVA-g-PSSS微球的CLSM圖(標尺為60 μm)。C. PPVA、PPVA-g-PSSS和DOX@PPVA-g-PSSS微球的表面和截面FESEM圖。D. 體外藥物釋放性能分析。
通過體外抗腫瘤活性測試表明,這種載藥微球對HepG2細胞具有明顯的抑制作用。兔耳動脈栓塞的結果表明在栓塞3、7、15天后,DOX在兔耳血管周圍組織的熒光強度沒有降低,載藥微球在組織中能維持較長時間的藥物濃度(圖6),這種新型藥物緩釋體系有望提高肝癌栓塞的治療效果。

圖6 A. 體外抗腫瘤活性分析:(a) 微球及藥物對HepG2細胞的毒性分析(CCK-8)。(b)和(c)分別為微球和藥物與HepG2細胞共孵育1 h和4 h的CLSM圖像。B. 兔耳組織中DOX熒光分布分析:(a)DOX@PPVA-g-PSSS微球栓塞兔耳中央動脈3天后微球在兔耳動脈分布的CLSM圖像(橫切面),(b)-(d)DOX@PPVA-g-PSSS微球分別栓塞兔耳中央動脈3、7、15天后DOX在血管周圍組織分布的熒光圖像。
該研究工作以“Preparation and evaluation of ion-exchange porous polyvinyl alcohol
microspheres as a potential drug delivery embolization system”為題發表在Materials Science & Engineering C上。
論文鏈接:https://www.sciencedirect.com/science/article/pii/S0928493121000278
此外,該團隊針對目前尚無載藥栓塞劑用于良性前列腺增生的治療和研究的現狀,開發了多種藥物遞送系統,將前列腺動脈栓塞術和局部藥物治療結合起來,對增強BPH的治療效果具有非常重要的意義,同時為開發新一代載藥栓塞材料用于良性前列腺增生的應用和研究提供了重要的實驗支撐。
研究成果分別發表在Materials Science & Engineering C 、Biomaterials Science 和Engineered Science上。
論文鏈接:
https://www.sciencedirect.com/science/article/pii/S0928493119337002
https://pubs.rsc.org/en/content/articlelanding/2020/bm/c9bm01775e#!divAbstract
http://www.espublisher.com/journals/articledetails/384
