顛覆認知:維生素C的“雙面人生”
你以為維生素C(VC)只是美白防感冒的“養(yǎng)生小能手”?中國科學(xué)技術(shù)大學(xué)李敏/王育才團隊最新研究發(fā)現(xiàn),高劑量VC竟是潛伏在腫瘤細胞內(nèi)部的“特洛伊木馬”——它通過偽裝成營養(yǎng)分子潛入腫瘤老巢,從內(nèi)部引爆“氧化炸彈”,聯(lián)手免疫系統(tǒng)對腫瘤細胞發(fā)起致命圍剿!這項發(fā)表于ACS Nano的研究,為腫瘤治療帶來安全、低成本的“膳食級”解決方案。
研究團隊發(fā)現(xiàn),腫瘤細胞高表達的SVCT2轉(zhuǎn)運受體使VC選擇性富集于病灶區(qū)域,在近紅外II區(qū)光熱(NIR-II PTT)引發(fā)的局部高溫下,VC通過級聯(lián)反應(yīng)放大氧化應(yīng)激,使腫瘤細胞對熱療的敏感性顯著提升。與此同時,兩者聯(lián)合激活的NF-κB信號通路驅(qū)動趨化因子CXCL16高表達,形成“免疫細胞導(dǎo)航信號”,吸引CXCR6+ T細胞浸潤至腫瘤部位,發(fā)揮腫瘤殺傷作用。臨床隊列分析顯示,腫瘤組織CXCL16和CXCR6的高表達與患者生存率及免疫細胞富集呈正相關(guān),提示該研究與實際臨床的一致性(圖1)。

圖1. 高劑量VC和NIR-II PTT的協(xié)同抗腫瘤作用。
首先,研究團隊發(fā)現(xiàn)高劑量VC與NIR-II PTT的聯(lián)合治療產(chǎn)生了遠超預(yù)期的抗腫瘤效果,且可達到“1+1>2”的協(xié)同增效作用。進一步研究發(fā)現(xiàn),VC存在明顯的劑量閾值效應(yīng),當VC劑量達到或超過1.5 g/kg時即可顯著增強光熱療效;隨著VC劑量增加,腫瘤組織中ROS水平呈明顯的劑量依賴性升高,提示了VC誘導(dǎo)的ROS產(chǎn)生對于其増敏光熱的重要性(圖2)。

圖2. 高劑量VC增強NIR-II PTT抗腫瘤效應(yīng)。
為了進一步揭示VC如何增強NIR-II PTT效果,研究團隊比較了腫瘤細胞和非腫瘤細胞在不同濃度VC處理后的存活情況。結(jié)果表明,VC能顯著降低結(jié)腸癌細胞CT26的活力,而對非腫瘤細胞NIH3T3幾乎無影響。且CT26細胞在VC處理后出現(xiàn)線粒體腫脹、損傷以及自噬體積聚等典型氧化損傷特征。在體內(nèi)實驗中,也觀察到VC對腫瘤組織的選擇性毒性效應(yīng)(圖3)。這一選擇性主要是通過腫瘤細胞表達VC轉(zhuǎn)運受體Glut1和SVCT2實現(xiàn)的。
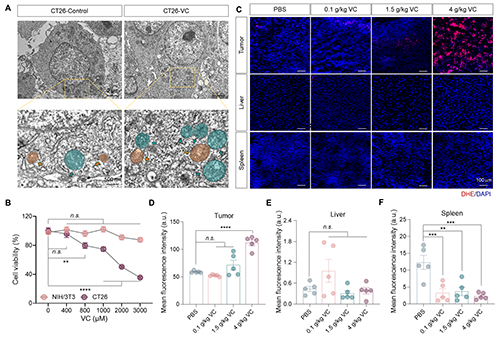
圖3. 高劑量VC選擇性誘導(dǎo)腫瘤細胞敏感性。
為了探究聯(lián)合療法是否依賴免疫系統(tǒng)介導(dǎo),結(jié)果顯示聯(lián)合治療組CD8+ T和CD4+ T細胞的腫瘤浸潤顯著增加,且CD8+ T細胞呈現(xiàn)更高比例的效應(yīng)記憶(CD44+ CD62L-)和中央記憶(CD44+ CD62L+)表型;且T細胞缺陷鼠和T細胞清除鼠中聯(lián)合療法的抗腫瘤效果消失,進一步證明T細胞免疫應(yīng)答在聯(lián)合療法抗腫瘤效果中的關(guān)鍵作用。進一步研究發(fā)現(xiàn),聯(lián)合治療可高效増敏免疫檢查點抑制劑療法(圖4)。

圖4. 聯(lián)合治療的協(xié)同殺傷作用依賴于T細胞免疫反應(yīng)。
最后,研究團隊通過RNA測序分析了聯(lián)合療法治療的早期階段腫瘤轉(zhuǎn)錄組變化,結(jié)果顯示聯(lián)合治療組呈現(xiàn)出免疫激活的特征,包括細胞因子和炎癥信號通路的上調(diào)(如Il6、Il7r、Nfkb1),以及T細胞募集相關(guān)趨化因子(如Ccl19、Cxcl16)的顯著升高,其可招募CXCR6+ T細胞的大量浸潤,發(fā)揮抗腫瘤效應(yīng)。研究團隊還通過分析結(jié)腸癌患者數(shù)據(jù)庫發(fā)現(xiàn),腫瘤組織CXCR6表達水平與患者生存期、CD8A和CD4表達高度正相關(guān),因此CXCR6表達可作為T細胞浸潤和患者預(yù)后良好的潛在生物標志物(圖5)。

圖5. 聯(lián)合療法誘導(dǎo)T細胞相關(guān)趨化因子表達。
相關(guān)工作以“Leveraging Vitamin C to Augment Nanoenabled Photothermal Immunotherapy”為題在ACS Nano發(fā)表。中國科學(xué)技術(shù)大學(xué)李敏副教授和王育才教授為論文的通訊作者,博士研究生鄧吳嫻和汪義媛為論文的第一作者。該研究工作得到了國家重點研發(fā)項目、國家自然科學(xué)基金、中國科學(xué)院戰(zhàn)略性先導(dǎo)科技專項、安徽省重點研發(fā)項目、安徽省重大科技專項項目、安徽省自然科學(xué)基金項目、中國科大“雙一流”項目和安徽省高校協(xié)同創(chuàng)新項目的資助。
論文鏈接:https://pubs.acs.org/doi/10.1021/acsnano.4c17080
