
開環(huán)聚合是一項(xiàng)合成主鏈功能高分子材料的重要策略。由于C(sp3)–N鍵廣泛存在于許多環(huán)狀有機(jī)化合物中,若能有效斷裂此類化學(xué)鍵,將為開環(huán)聚合提供一種新穎的途徑。然而,C(sp3)–N鍵具有較高的鍵解離能,導(dǎo)致其斷裂難度相當(dāng)大。目前的研究主要依賴于高環(huán)張力單體(如氮丙啶、氮雜環(huán)丁烷和扭曲酰胺)來驅(qū)動(dòng)C(sp3)–N鍵的斷裂以實(shí)現(xiàn)開環(huán)聚合。而在無明顯環(huán)張力的環(huán)狀單體中實(shí)現(xiàn)C(sp3)–N鍵的斷裂,仍然面臨著巨大的挑戰(zhàn)(圖1)。
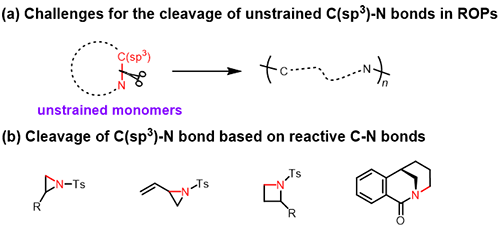
圖1. C(sp3)-N鍵斷裂在開環(huán)聚合中的應(yīng)用
中山大學(xué)黃漢初課題組主要致力于硫自由基聚合及大環(huán)開環(huán)聚合方法的研究,旨在為主鏈功能高分子材料的可控制備提供高效的合成技術(shù)。在前期工作中,他們首次利用“邁克爾加成-斷裂”機(jī)制成功實(shí)現(xiàn)了無張力環(huán)狀單體中C(sp3)–S鍵的選擇性切斷,構(gòu)建了一類新穎的開環(huán)聚合反應(yīng)體系,并成功制備了分子量可控、分布窄且能夠在主鏈嵌入任意基團(tuán)的含硫高分子材料(Angew. Chem. Int. Ed. 2023, 62, e202217895)。在本項(xiàng)研究中,他們與華南理工大學(xué)曹德榕教授課題組合作,進(jìn)一步將該策略拓展至無張力環(huán)狀單體中的C(sp3)–N鍵斷裂,首次實(shí)現(xiàn)了基于邁克爾加成-斷裂機(jī)制的C(sp3)–N鍵斷裂開環(huán)聚合反應(yīng)(圖2)。同時(shí),從機(jī)理角度出發(fā),作者將他們所發(fā)展的這類聚合反應(yīng)正式命名為“邁克爾加成–斷裂開環(huán)聚合(Michael Addition–Fragmentation Ring–Opening Polymerization, MAFROP, /![]() )”,以便更加系統(tǒng)地開發(fā)和研究這類基于“邁克爾加成-斷裂”機(jī)制的開環(huán)聚合反應(yīng)。
)”,以便更加系統(tǒng)地開發(fā)和研究這類基于“邁克爾加成-斷裂”機(jī)制的開環(huán)聚合反應(yīng)。
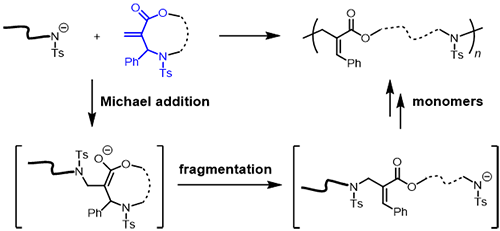
圖2. 基于C(sp3)-N鍵斷裂的邁克爾加成-斷裂開環(huán)聚合反應(yīng)
在本項(xiàng)研究中,作者首先設(shè)計(jì)并合成了新型環(huán)狀單體M1,并在室溫空氣條件下篩選了不同的引發(fā)劑。結(jié)果表明,N-乙基甲磺酰胺基鉀(Init2)展現(xiàn)出優(yōu)異的聚合控制性能,所得聚合物的理論分子量(Mn,theo)與核磁分子量(Mn,NMR)高度吻合(圖3)。在最優(yōu)反應(yīng)條件下,具有不同碳鏈長(zhǎng)度的單體M1–M3均能實(shí)現(xiàn)可控聚合。通過調(diào)控單體與引發(fā)劑的比例,成功合成了分子量可調(diào)、分布窄的聚合物。值得一提的是,所得聚合物中肉桂酸酯結(jié)構(gòu)以順式構(gòu)型為主(>90% cis)。此外,通過調(diào)節(jié)環(huán)尺寸,可以靈活地控制主鏈中氮原子的間距,這對(duì)于傳統(tǒng)單體(如氮丙啶和氮雜環(huán)丁烷)而言極具挑戰(zhàn)性。
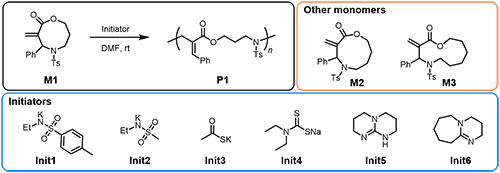
圖3. 聚合反應(yīng)研究
動(dòng)力學(xué)研究表明,該聚合反應(yīng)遵循一級(jí)反應(yīng)動(dòng)力學(xué)規(guī)律,數(shù)均分子量(Mn)與轉(zhuǎn)化率呈線性關(guān)系,且整個(gè)聚合過程中分子量分布保持較窄水平(![]() < 1.1)。進(jìn)一步的MALDI-TOF質(zhì)譜分析顯示,每組主峰間隔的數(shù)值和聚合物重復(fù)單元的分子量相同,且聚合物具有完整的末端結(jié)構(gòu)。基于此,作者進(jìn)行了鏈延伸實(shí)驗(yàn),成功制備了不同的嵌段共聚物。首先,通過M1的均聚合成大分子鏈轉(zhuǎn)移劑P1,隨后一鍋法加入M2進(jìn)行鏈延伸,成功得到了二嵌段共聚物P1-b-P2。同樣,使用單體M1和M3亦可成功制備嵌段共聚物P1-b-P3。此外,通過順序加入M1、M2和M3能夠一鍋法制備三嵌段共聚物P1-b-P2-b-P3,且能夠精準(zhǔn)控制聚合物分子量及其分布。這些實(shí)驗(yàn)不僅驗(yàn)證了MAFROP的可控性,更突出了該方法在合成具有明確結(jié)構(gòu)聚合物方面的高效性。
< 1.1)。進(jìn)一步的MALDI-TOF質(zhì)譜分析顯示,每組主峰間隔的數(shù)值和聚合物重復(fù)單元的分子量相同,且聚合物具有完整的末端結(jié)構(gòu)。基于此,作者進(jìn)行了鏈延伸實(shí)驗(yàn),成功制備了不同的嵌段共聚物。首先,通過M1的均聚合成大分子鏈轉(zhuǎn)移劑P1,隨后一鍋法加入M2進(jìn)行鏈延伸,成功得到了二嵌段共聚物P1-b-P2。同樣,使用單體M1和M3亦可成功制備嵌段共聚物P1-b-P3。此外,通過順序加入M1、M2和M3能夠一鍋法制備三嵌段共聚物P1-b-P2-b-P3,且能夠精準(zhǔn)控制聚合物分子量及其分布。這些實(shí)驗(yàn)不僅驗(yàn)證了MAFROP的可控性,更突出了該方法在合成具有明確結(jié)構(gòu)聚合物方面的高效性。
為了深入理解該聚合反應(yīng)的機(jī)理與立體選擇性來源,作者進(jìn)行了密度泛函理論(DFT)計(jì)算。結(jié)果表明,邁克爾加成能壘低于β-斷裂能壘,表明后者為決速步并主導(dǎo)產(chǎn)物的立體構(gòu)型。接著,作者對(duì)β-斷裂過程中形成順反產(chǎn)物的兩種可能過渡態(tài)(cis-TS2與trans-TS2)進(jìn)行了計(jì)算。計(jì)算結(jié)果顯示,過渡態(tài)cis-TS2(14.8 kcal/mol)的能壘顯著低于trans-TS2的能壘(25.5 kcal/mol),說明順式肉桂酸酯的形成更有利。進(jìn)一步的過渡態(tài)結(jié)構(gòu)分析發(fā)現(xiàn),八元環(huán)內(nèi)Et(Ts)NCH2-基團(tuán)與氫原子之間的跨環(huán)張力可能是trans-TS2能量高于cis-TS2的原因(圖4)。為了驗(yàn)證這一推測(cè),作者合成了非環(huán)狀化合物并進(jìn)行了對(duì)比實(shí)驗(yàn),結(jié)果表明,產(chǎn)物主要為反式構(gòu)型,進(jìn)一步證實(shí)了環(huán)狀單體開環(huán)聚合所觀察到的較高順式立體選擇性主要源于跨環(huán)張力的驅(qū)動(dòng)。
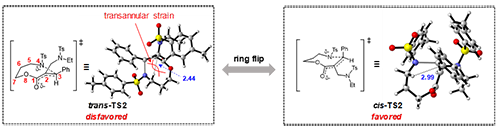
圖4. 聚合反應(yīng)機(jī)理的研究
此外,作者進(jìn)一步將 MAFROP 策略拓展至與 N-磺酰基氮丙啶的共聚中(圖5)。通過改變兩類單體的投料順序,成功制備了兩種嵌段共聚物P1-b-PTsMAz和PTsMAz-b-P1,并通過DOSY譜證實(shí)了嵌段共聚物的成功合成。隨后,利用甲醇鈉處理二嵌段共聚物PTsMAz-b-P1時(shí),P1段可被選擇性降解,而PTsMAz段保持穩(wěn)定,展示了該方法在聚合物功能化及降解性調(diào)控方面的應(yīng)用潛力。
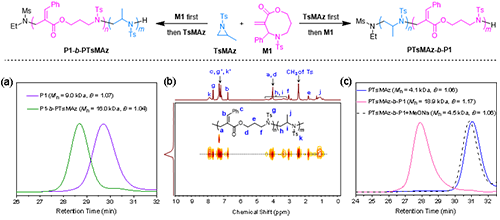
圖5. 與N-磺酰基氮丙啶的共聚研究
最后,作者采用模塊化方法將酯序列與開環(huán)機(jī)關(guān)結(jié)合,簡(jiǎn)便地合成了包含ABCDE五元序列的大環(huán)單體M4。通過對(duì)M4進(jìn)行開環(huán)聚合,成功構(gòu)建了分子量可控且分布窄的主鏈序列可控聚合物(圖6)。值得注意的是,這類聚合物通常難以通過逐步聚合(其缺點(diǎn)在于分子量不可控)或傳統(tǒng)開環(huán)聚合(其缺點(diǎn)在于難以在主鏈上引入任意指定的官能團(tuán))等方法進(jìn)行制備。這一結(jié)果標(biāo)志著MAFROP策略在主鏈功能高分子材料可控制備方面邁出了關(guān)鍵一步。
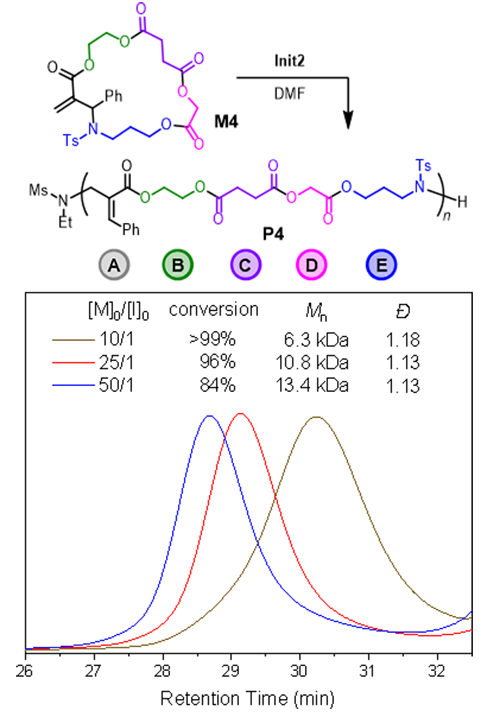
圖6. 序列可控聚合物的合成
總結(jié),本研究創(chuàng)新性地開發(fā)了一種基于C(sp3)–N鍵斷裂的邁克爾加成–斷裂開環(huán)聚合(MAFROP)新反應(yīng)體系。該聚合反應(yīng)可在溫和條件下高效進(jìn)行,合成分子量可控、分布窄且具有順式立體選擇性的肉桂酸酯類聚胺。此外,該聚合方法進(jìn)一步擴(kuò)展至與N-磺酰基氮丙啶的共聚以及序列可控聚合物的合成,展示了該類聚合反應(yīng)在制備具有多樣化主鏈結(jié)構(gòu)的功能高分子材料方面的廣闊應(yīng)用前景。該研究工作以“Aza-Michael Addition–Fragmentation Ring–Opening Polymerization”為題發(fā)表于《美國化學(xué)會(huì)會(huì)志》(J. Am. Chem. Soc. 2025, DOI: 10.1021/jacs.5c03181),第一作者為黃丹同學(xué)。感謝國家自然科學(xué)基金和廣東省自然科學(xué)基金對(duì)本項(xiàng)目的資助,同時(shí)也感謝在研究過程中給予幫助的朋友、老師和學(xué)生。
原文鏈接:https://pubs.acs.org/doi/10.1021/jacs.5c03181
