糖尿病足等慢性傷口由于滲出、感染及缺氧等因素,長期滯留于炎癥、增殖或重塑階段,愈合緩慢、周期延長。目前臨床常用敷料以物理隔離和滲液吸收為主,主要發揮被動保護作用,難以實現對傷口修復過程的主動調控。設計開發出一種能進行傷口主動電刺激(ES)干預的智能敷料,仍面臨良好透氣性、生物相容性和外部電源依賴等關鍵挑戰。
近日,新加坡南洋理工大學魏磊教授團隊設計了一種基于熱電效應的熱原電池(TGC)敷料。針對慢性傷口護理需求,材料中引入微納米纖維網絡以提升其透濕性與機械穩定性。實驗證實,該敷料的水蒸氣透過率(WVT)與棉紗布相當,有效規避傷口浸漬風險;鐵離子釋放測試顯示,藻酸鹽網絡可穩定限制Fe2?遷移,顯著降低離子泄漏,提升其生物安全性與應用可靠性(圖1)。研究團隊建立了大鼠皮膚缺損模型,測得傷口中心與邊緣的表皮電位差增幅達53 mV,該增強源于TGC敷料產生的外源性電場,與傷口內源電場協同作用,從而有效增強局部電位差(圖2)。TGC敷料在傷口滲出液管理中展現出良好性能。體外實驗表明,其對綠膿桿菌與金黃色葡萄球菌的抑菌率超過99.9%,同時,Fe離子的穩定存在提升了敷料的細胞相容性。劃痕實驗顯示,TGC敷料產生的電場可促進細胞遷移。在糖尿病大鼠全層皮膚缺損模型中,TGC敷料顯著加快創面閉合。豬皮膚創傷模型實驗表明其具備良好的抗菌與促愈合協同作用(圖3)。研究團隊還開發了基于TGC敷料的無線監測系統,實現對創面電位、溫度動態及呼吸頻率的實時記錄(圖4)。這項研究工作拓展了慢性傷口智能化管理的技術路徑。
2025年7月14日,該工作以“A thermogalvanic cell dressing for smart wound monitoring and accelerated healing”為題發表在期刊《Nature Biomedical Engineering》上。文章第一作者為南洋理工大學博士后辛集武博士和上海交通大學醫學院博士后高立恒博士。
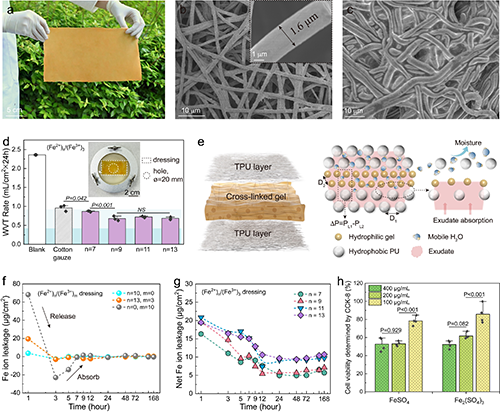
圖1 纖維復合TGC 敷料的透濕性和離子泄漏特性
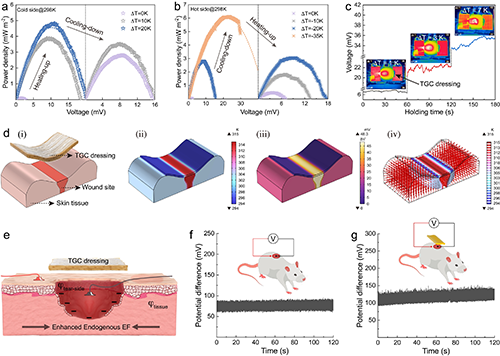
圖2 TGC 敷料的熱電效應和傷口外源性電場的增強

圖3 TGC 敷料的體外和體內生物相容性及愈合特性
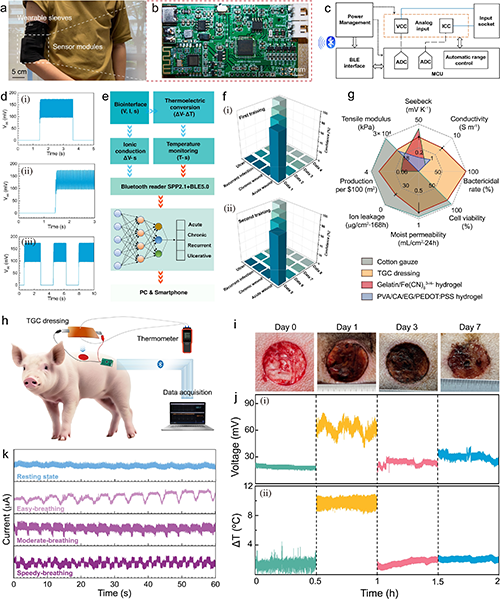
圖4 TGC 敷料的便攜式傷口監測分析系統
本研究將熱電效應引入傳統生物材料體系,提出了一種面向慢性傷口治療的多功能智能敷料策略。所構建的TGC敷料集成了溫度監測、滲液管理與電刺激干預功能,展現出良好的協同性能與臨床應用潛力。同時,配套開發的可穿戴無線系統可實現傷口溫度的實時追蹤、智能識別及呼吸頻率監測,推動傷口管理向數字化、個性化方向轉型,拓展了慢性傷口治療的新路徑。該策略已在糖尿病及細菌感染相關的全層皮膚缺損動物模型中完成初步驗證。未來研究可進一步拓展至其他類型傷口(如燒傷、免疫功能障礙、神經系統相關創傷等),并結合多組學分析深入解析調控機制,加速智能敷料的臨床轉化進程。
原文鏈接:https://www.nature.com/articles/s41551-025-01440-6
