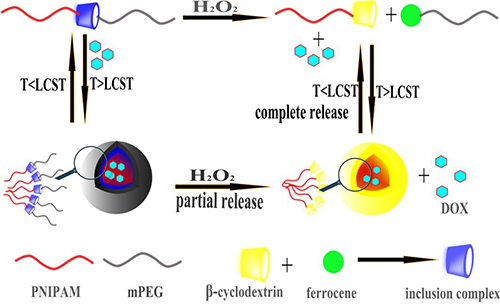
刺激響應性聚合物膠束可以對諸如pH、溫度、光照、氧化劑、酶以及超聲輻照等外界環境的刺激做出反饋性響應,已被廣泛應用于藥物載體、傳感器、納米器械等諸多領域。但是,傳統的刺激響應性聚合物具有響應性單一、不能實時調控等缺陷,限制了其進一步的發展與應用。
中國科學院成都生物研究所研究員李幫經長期致力于基于環糊精主客體識別的自組裝生物醫藥材料研究,針對傳統的刺激響應性聚合物膠束的缺陷,借鑒均聚物正交自組裝的方法(Homopolymer Orthogonal Self-Assembly, HOSA),利用環糊精與二茂鐵的可逆性主-客體識別作用將二茂鐵修飾的聚乙二醇單甲醚(mPEG-Fc)與β-環糊精修飾的N-異丙基丙烯酰胺(PNIPAM-β-CD)通過可逆的非共價鍵鏈接來構筑超分子嵌段共聚物mPEG-Fc/ PNIPAM-β-CD,并研究其氧化劑和溫度的雙重環境刺激響應性行為。在水溶液中,當溫度高于PNIPAM的臨界轉變濃度(lower critical solution temperature, LCST)時,完全親水的超分子嵌段共聚物mPEG-Fc/ PNIPAM-β-CD將會變為兩親性分子,并進一步在水中自組裝為膠束結構進行藥物的包裹(如圖所示)。當加入雙氧水作為氧化劑時,由于雙氧水二茂鐵氧化為帶正電的離子態Fc+,Fc+不能與環糊精產生包合,使得原有的包合結構瓦解,并伴隨著藥物的部分釋放,超分子嵌段共聚物變為mPEG-Fc+和PNIPAM-β-CD。而由于此時溫度仍然在PNIPAM的LCST之上,PNIPAM-β-CD可以二次組裝形成以PNIPAM鏈段為疏水性內核,以β-CD為親水性外殼的次級膠束結構,并將部分藥物包裹在此次級膠束結構之中。當進一步降低體系的溫度至PNIPAM的LCST之下時,PNIPAM鏈段完全變為親水,使得次級膠束結構瓦解,伴隨著藥物的完全釋放。該膠束體系具有釋放可控的優良特性,可以利用腫瘤細胞內的高濃度的H2O2環境與簡單的冰敷降溫或冷凍探針方法,實現藥物的定量釋放。
相關文章發表在國際雜志ACS Macro Letters上。
新聞來源:http://www.cas.cn/syky/201505/t20150506_4350228.shtml
- 西南交大魏桂花團隊 AHM:基于小球藻水凝膠的光響應性供氧系統促進面神經損傷修復-M1/M2型巨噬細胞與施萬細胞的交互作用 2025-06-10
- 東華大學史向陽教授團隊:外泌體包裹的響應性樹狀大分子納米凝膠可實現急性肺損傷的免疫調節和抗氧化聯合治療 2025-05-15
- 四川大學李建樹教授/謝婧副研究員、大連理工孫文研究員 AFM:一種具有pH響應性和軟骨滲透能力的超分子納米顆粒治療骨關節炎 2025-04-30
- 復旦大學彭娟團隊三發 Macromolecules:基于共軛高分子凝聚態結構調控的最新進展 2024-05-12
- 西安交大黃銀娟教授團隊 Small:pH靈活調控的共軛均聚物1D多級自組裝 2024-02-26
- 南開大學齊跡、孔德領/醫學科學院工程所李穩 Nat. Commun.:長波長NIR-II光聲成像可視化血栓協同治療 2023-11-02
- 西南醫大口腔醫院陶剛/黎春暉/蔡蕊團隊:具有ROS觸發藥物釋放特性的可注射水凝膠實現抗菌劑和抗炎納米顆粒協同遞送用于牙周炎治療 2025-04-15
