近日,復旦大學化學系黎占亭研究團隊、張凡研究組和美國勞倫斯·伯克利國家實驗室劉毅研究員合作,利用本實驗室創立的超分子有機框架 (Supramolecular Organic Framework, SOF)為載體,成功開發出簡化的sof-DDS新技術。研究結果分別以“In situ-prepared homogeneous supramolecular organic framework drug delivery systems (sof-DDSs): overcoming cancer multidrug resistance and controlled release”和“Loading-free supramolecular organic framework drug delivery systems (sof-DDSs) for doxorubicin: normal plasm and multidrug resistant cancer cell-adaptive delivery and release”為題目,在線發表于《中國化學快報》(Chinese Chemical Letters, DOI: 10.1016/j.cclet.2017.01.010; 10.1016/j.cclet.2017.01.005)。論文第一作者分別為化學系博士生田佳和姚池。
癌癥為威脅人類健康的第一大疾病殺手,化藥治療是除手術之外的最重要治療手段。但化藥治療也面臨很多挑戰,如會產生各種嚴重副作用、腫瘤細胞產生耐藥性、缺少靶向性及生物利用度低等。很多分子藥物水溶性低,也限制了它們的臨床應用。藥物遞送體系(drug delivery system, DDS)可在相當程度上克服上述化療缺點。因此,用于癌癥治療的DDS研發一直受到學術界和工業界重視。但目前美國FDA批準上市的遞送藥物總計只有6個,中國只有3個左右,且全是脂質體(liposomal)體系。目前FDA批準的用于癌癥治療的化學藥物已有140余個。因此,DDS研發與抗癌新藥研發相比嚴重滯后。另外,目前臨床使用的脂質體藥物與原藥相比,價格都大幅度攀升,提高達4-200倍,不僅嚴重加大患者的經濟負擔,也限制了遞送型藥物為絕大多數普通患者所使用。按市場規模推算,目前我國只有不到1%的患者能夠按療程使用遞送藥物治療。因此,發展低成本高效藥物遞送新技術具有重大的社會效益和廣闊的市場。
研究團隊所開發新技術的核心是利用SOF的均相有序納米孔結構特征,在水中通過非共價鍵作用驅動,直接把藥物吸收到納米孔內部。由于SOF具有納米尺度效應,被吸收的藥物經靜脈注射后,在血液循環中可避免大量流失,并能夠通過耐藥性癌細胞的屏蔽效應。進入癌細胞后,藥物受腫瘤細胞內酸性介質質子化,消除了與SOF的相互作用力,由此可以實現有效釋放。對負離子藥物培美曲塞(pemetrexed, PMX)和中性藥物阿霉素(doxorubicin, DOX)的細胞和動物實驗研究表明,SOFs可以克服腫瘤細胞的多藥耐藥性(multidrug resistance, MDR),與原藥相比,IC50 (half maximal inhibitory concentration)值降低5-19倍。
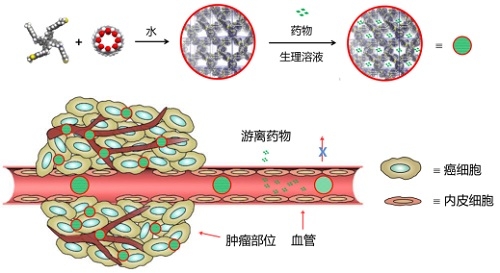
目前臨床使用的脂質體DDS藥物價格高昂,一個主要因素是,藥物需要被負載或包埋在脂質體的內部。這一過程如同一個以藥物為原料的產率極低的有機反應,后續分離純化過程復雜,質量控制要求極高,并且部分輔助原料價格昂貴。新的sof-DDS技術省去了上述所有步驟,只需把載體和藥物在水中混溶即可使用。構建sof-DDS的有機單體可以從低價原料出發,通過數步反應制備,成本遠低于絕大多數化療藥物,因此,這類自組裝型的載體提供了未來發展低成本遞送藥物的新一代技術。另外,sof-DDS為分離式平臺,一旦開發成功,可以實現不同藥物的遞送,也有利于進一步降低成本。
據悉,本項研究得到國家自然科學基金委、科技部、教育部和上海市科委資助。
