浙大周民教授團隊 Bioact. Mater.:微藻藥物遞送系統"降尿酸-抗炎-消化系統保護"三位一體協同用于痛風性關節炎的治療
2025-06-04 來源:高分子科技
痛風性關節炎(Gouty Arthritis, GA)是由尿酸代謝異常導致尿酸鹽(MSU)結晶在關節及周圍組織沉積所引發的炎癥性疾病。該疾病以關節劇烈疼痛、腫脹和活動受限為主要臨床表現,已成為全球最常見的炎癥性關節疾病之一。流行病學數據顯示,過去二十年間其發病率增長超過兩倍,嚴重影響患者生活質量。當前該疾病的臨床治療面臨兩大難題:一線藥物秋水仙堿(Col)雖具有良好的抗炎效果,但其治療劑量接近中毒劑量,約20%患者會出現腹瀉、嘔吐等胃腸道不良反應;此外,目前尚無藥物能夠同時干預高尿酸血癥(HUA)和關節炎癥兩個病理過程。
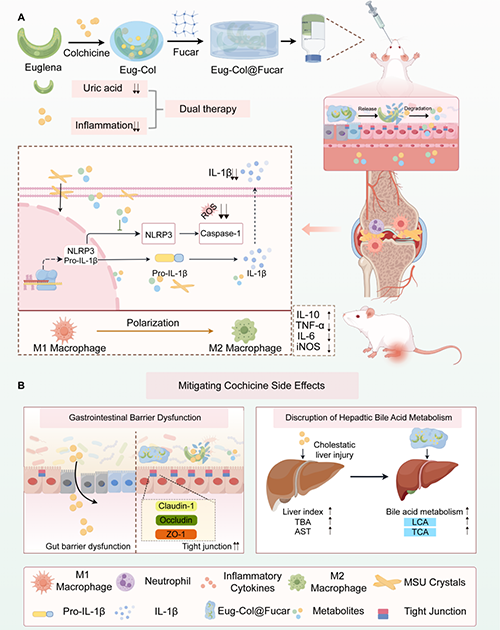
針對上述問題,浙江大學州民教授團隊開發了一種基于開發了一種基于裸藻(Eug)、秋水仙堿(Col)和巖藻糖卡拉膠復合物(Fucar)的口服水凝膠系統(Eug-Col@Fucar) 將裸藻的尿酸吸附特性、巖藻糖卡拉膠復合物的腸道保護功能與秋水仙堿的抗炎作用有機結合。首次實現了"降尿酸-抗炎-消化系統保護"三位一體協同治療,為痛風患者提供了更安全高效的治療方案。實驗結果表明,Eug-Col@Fucar能有效降低血清尿酸水平,清除自由基和活性氧(ROS),促進巨噬細胞向M2型抗炎表型極化,抑制NLRP3-IL-1β信號通路,從而改善痛風性關節炎。此外,該系統顯著緩解了秋水仙堿引起的胃腸道不良反應,如胃腸絨毛結構異常和屏障通透性增加等問題。由于富含多糖成分,該水凝膠系統還能改善膽汁酸代謝,從而減輕秋水仙堿誘導的肝毒性。此外,安全性評估也證實了該復合物的良好生物相容性,為未來臨床應用奠定了基礎。

該文章近期以《Microalgae-based hydrogel drug delivery system for treatment of gouty arthritis with alleviated colchicine side effects》為題發表于《Bioactive Materials》上。
本研究開發了一種Eug-Col@Fucar水凝膠系統,用于共同傳遞Eug和Col,制得了更加穩定和均勻的制劑。該水凝膠通過將巖藻糖(Fuc)與不同濃度的卡拉膠(Car)混合,誘導凝膠化。結果表明,隨著卡拉膠濃度的增加,水凝膠展現了良好的剪切變稀特性和可注射性,并且凝膠的彈性得到了顯著增強。掃描電子顯微鏡(SEM)圖像顯示,巖藻糖和卡拉膠通過協同作用形成了致密的凝膠網絡,且隨著卡拉膠濃度的增加,凝膠孔徑減小,從而提高了凝膠的強度和穩定性。Eug-Col復合物成功地被包載進Fucar水凝膠中,并且在加載后水凝膠呈現綠色,顯示出優良的可注射性。體外藥物釋放實驗表明,Eug-Col@Fucar能夠有效保護Col免受胃酸的降解,允許在小腸中進行控制釋放,從而提高了Col的生物利用度并減少了胃腸道毒性。總體來說,Fucar水凝膠系統對于Eug和Col的口服遞送是一個有效的載體。
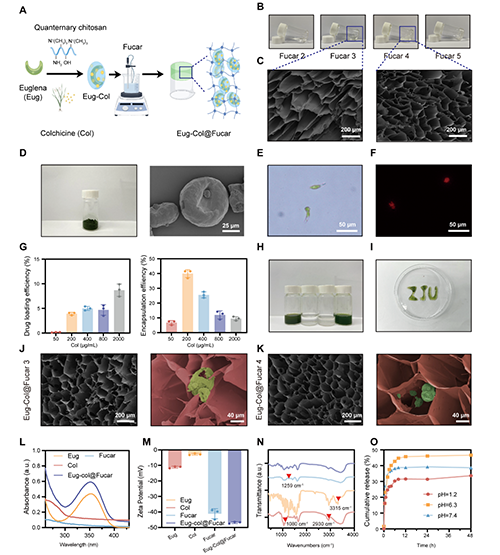 圖1. Eug-Col@Fucar的合成與表征。(A) Eug-Col@Fucar合成示意圖(B)不同濃度的Fucar水凝膠。(C) Fucar 3和Fucar 4的代表性SEM圖像。(D) Eug冷凍照片和Eug的代表性SEM圖像。(E) 代表Eug的亮場和(F)熒光圖像。(G) Eug-Col溶液的載藥效率和包封效率。(H) Eug-Col的照片溶液,Col溶液,Fucar 4水凝膠,Eug-Col@Fucar水凝膠。(I) Eug-Col@Fucar的可注射性。(J) Eug-Col@Fucar具有代表性的SEM圖像低倍放大(左)和高倍放大(右)下。紅色:Fucar。綠色:Eug-Col。(K) Eug-Col@Fucar 4在低放大(左)和高倍放大(右)下的代表性SEM圖像。紅色:Fucar。綠色:Eug-Col。(L) Eug的紫外-可見吸收光譜,(M) Zeta電位,(N) FTIR光譜;Col,Fucar和Eug-Col@Fucar。(O)Eug-Col@Fucar在不同pH值下PBS中的累積Col釋放量。
圖1. Eug-Col@Fucar的合成與表征。(A) Eug-Col@Fucar合成示意圖(B)不同濃度的Fucar水凝膠。(C) Fucar 3和Fucar 4的代表性SEM圖像。(D) Eug冷凍照片和Eug的代表性SEM圖像。(E) 代表Eug的亮場和(F)熒光圖像。(G) Eug-Col溶液的載藥效率和包封效率。(H) Eug-Col的照片溶液,Col溶液,Fucar 4水凝膠,Eug-Col@Fucar水凝膠。(I) Eug-Col@Fucar的可注射性。(J) Eug-Col@Fucar具有代表性的SEM圖像低倍放大(左)和高倍放大(右)下。紅色:Fucar。綠色:Eug-Col。(K) Eug-Col@Fucar 4在低放大(左)和高倍放大(右)下的代表性SEM圖像。紅色:Fucar。綠色:Eug-Col。(L) Eug的紫外-可見吸收光譜,(M) Zeta電位,(N) FTIR光譜;Col,Fucar和Eug-Col@Fucar。(O)Eug-Col@Fucar在不同pH值下PBS中的累積Col釋放量。
(2)Eug-Col@Fucar的體外生物相容性及抗氧化作用
Eug(一種富含抗氧化成分的微藻)與Col(治療痛風的臨床藥物)在Fucar水凝膠載體中協同作用,能夠顯著增強細胞活力,并減輕Col的細胞毒性。Eug和Fucar顯示了良好的生物兼容性,并促進了細胞的增殖。Eug在清除自由基方面表現優異,并與Col一起對抗氧化應激提供保護。此外,Eug-Col@Fucar系統在體外實驗中有效地清除了過氧化氫和自由基,且在LPS誘導的氧化應激中顯著減少了ROS的生成,表現出較強的抗氧化作用。總體而言,Eug-Col@Fucar不僅具有較強的抗氧化能力,還能夠有效減少氧化損傷,具有在治療炎癥性疾病中的應用前景。
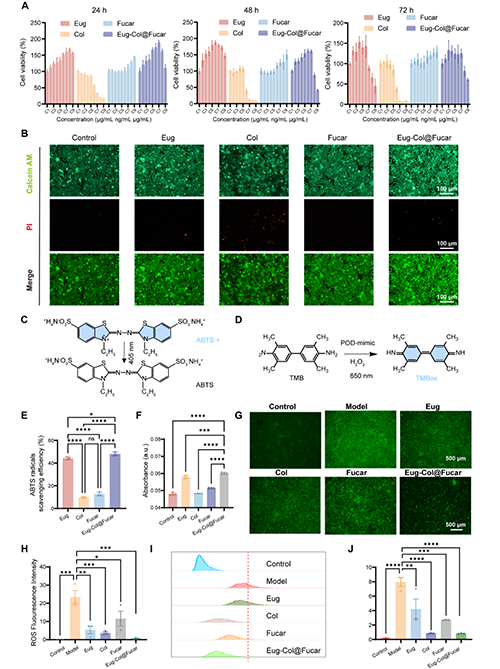 圖2.體外生物相容性及抗氧化作用評價。(A)用CCK8法測定不同濃度的Eug、Col、Fucar和Eug-Col@Fucar處理RAW264.7細胞24小時、48小時和72小時細胞活力。(B)用Eug、Col、Fucar和Eug-Col@Fucar處理RAW264.7細胞24小時的活死染色。(C) ABTS自由基清除實驗示意圖。(D) TMB法檢測過氧化物酶活性示意圖。(E)不同材料對ABTS自由基的清除效率。(F)不同處理后650 nm oxTMB吸光度。(G)不同處理后RAW 264.7細胞胞內ROS生成的DCFH-DA染色。(H) RAW 264.7細胞胞內ROS熒光強度定量。(I)不同處理后RAW 264.7細胞ROS生成的流式細胞術分析。(J)流式細胞術分析中平均熒光強度的定量。
圖2.體外生物相容性及抗氧化作用評價。(A)用CCK8法測定不同濃度的Eug、Col、Fucar和Eug-Col@Fucar處理RAW264.7細胞24小時、48小時和72小時細胞活力。(B)用Eug、Col、Fucar和Eug-Col@Fucar處理RAW264.7細胞24小時的活死染色。(C) ABTS自由基清除實驗示意圖。(D) TMB法檢測過氧化物酶活性示意圖。(E)不同材料對ABTS自由基的清除效率。(F)不同處理后650 nm oxTMB吸光度。(G)不同處理后RAW 264.7細胞胞內ROS生成的DCFH-DA染色。(H) RAW 264.7細胞胞內ROS熒光強度定量。(I)不同處理后RAW 264.7細胞ROS生成的流式細胞術分析。(J)流式細胞術分析中平均熒光強度的定量。
(3)Eug-Col@Fucar巨噬細胞重編程和體外抗炎能力的研究
Eug-Col@Fucar系統在治療痛風性關節炎(GA)中具有潛力。研究表明,Eug-Col@Fucar能夠顯著誘導小鼠巨噬細胞從M1型(促炎性)轉變為M2型(抗炎性),并且通過這種轉化有效地抑制了炎癥反應。實驗中,Eug-Col@Fucar顯著提高了M2型巨噬細胞的比例,減少了M1型巨噬細胞的比例,從而降低了與痛風相關的炎癥因子(如TNF-α、IL-6、IL-1β)的表達。與Eug、Col、Fucar單獨處理相比,Eug-Col@Fucar表現出更強的抗炎作用,能夠有效抑制M1型標志基因的表達,并增強M2型標志基因的表達。因此,Eug-Col@Fucar系統能夠有效重編程巨噬細胞,轉化為抗炎性的M2型巨噬細胞,為痛風性關節炎的治療提供了一種理想的生物材料。
 圖3. 巨噬細胞重編程及體外抗炎能力評價。(A)巨噬細胞重編程示意圖。(B) Eug、Col、Fucar和Eug-Col@Fucar處理后的M1和M2巨噬細胞比例的流式細胞術分析。(C)免疫熒光染色和(D) Eug-Col@Fucar處理后CD86 (M1標記,紅色)和CD206 (M2標記,綠色)的定量。(e) qPCR檢測M1巨噬細胞基因(TNF-α、IL-6、NLRP3、IL-1β和iNOS)的表達。(J) qPCR檢測M2巨噬細胞基因(IL-10)的表達。(K) 不同處理后TNF-α(綠色)的免疫熒光染色。(L) TNF-α的相對熒光強度定量。(M)不同處理后IL-6(綠色)的免疫熒光染色。(N)定量IL-6的相對熒光強度。
圖3. 巨噬細胞重編程及體外抗炎能力評價。(A)巨噬細胞重編程示意圖。(B) Eug、Col、Fucar和Eug-Col@Fucar處理后的M1和M2巨噬細胞比例的流式細胞術分析。(C)免疫熒光染色和(D) Eug-Col@Fucar處理后CD86 (M1標記,紅色)和CD206 (M2標記,綠色)的定量。(e) qPCR檢測M1巨噬細胞基因(TNF-α、IL-6、NLRP3、IL-1β和iNOS)的表達。(J) qPCR檢測M2巨噬細胞基因(IL-10)的表達。(K) 不同處理后TNF-α(綠色)的免疫熒光染色。(L) TNF-α的相對熒光強度定量。(M)不同處理后IL-6(綠色)的免疫熒光染色。(N)定量IL-6的相對熒光強度。
(4)Eug-Col@Fucar的熒光成像性質及生物分布
Eug-Col@Fucar在口服給藥后的生物分布研究表明,該復合材料能夠有效延長藥物在體內的滯留時間,促進藥物的吸收并增強治療效果。通過熒光成像觀察發現,Eug-Col@Fucar主要分布在小腸,尤其是回腸,并且在24小時內,Eug-Col@Fucar在小腸的熒光信號強度和持續時間顯著高于自由的Eug和Col。此外,未在主要器官(如心臟、肝臟、脾臟、肺和腎臟)中檢測到Eug積聚,說明Eug-Col@Fucar在口服后主要在胃腸道內發揮作用。通過定量分析發現,雖然Fucar涂層使FITC的熒光強度有所降低,但Eug-Col@Fucar組在24小時后的信號更為顯著,表明Col的滯留時間得到了延長。凍切片的腸道組織進一步證明了Eug-Col@Fucar能夠有效地保持Eug和Col的熒光信號,且與單獨使用Eug和Col的組相比,表現出更強的熒光。在降解過程方面,Eug-Col@Fucar在胃腸道內表現出優異的生物降解性。其在小腸和盲腸逐漸解體,到達結腸時幾乎完全降解,證明了其良好的生物可降解性。綜上所述,Eug-Col@Fucar能夠有效延長藥物在體內的滯留時間,增強藥物吸收,并且具有優異的生物降解性,顯示出其作為口服給藥系統的潛力。
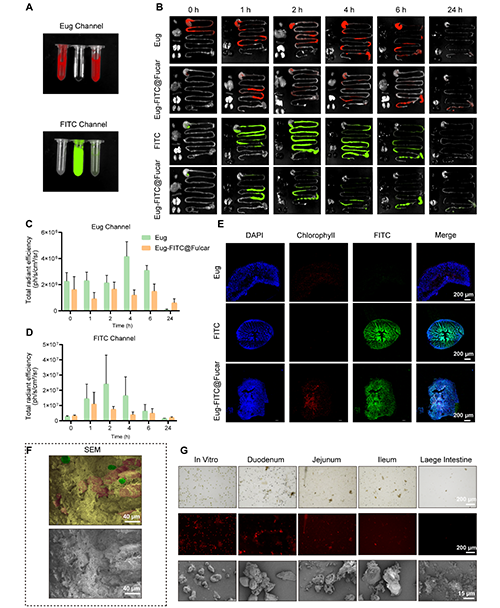 圖4. Eug-FITC@Fucar的熒光成像及生物分布。(A) 在Eug通道和FITC通道下,FITC、Eug和Eug-FITC@Fucar的體外熒光成像(B) 分別在Eug通道和FITC通道下口服FITC、Eug或Eug-FITC@Fucar(等量FITC或Eug) 0、1、2、4、6和24小時小鼠主要器官(心、肝、脾、肺、腎和胃腸道)的代表性熒光圖像。(C) Eug通道和(D) FITC通道下各時間點的熒光定量。(E) 小鼠灌胃后。Eug 、FITC和Eug-FITC@Fucar后同一位置腸道組織冷凍切片的代表性熒光圖像。(F) 灌胃Eug-Col@Fucar后小鼠腸道組織代表性SEM(下)和偽彩色SEM(上)圖像。(G) 小鼠胃腸道不同部位內容物代表性亮場顯微鏡圖像(上)、熒光圖像(中)和SEM圖像(下)。
圖4. Eug-FITC@Fucar的熒光成像及生物分布。(A) 在Eug通道和FITC通道下,FITC、Eug和Eug-FITC@Fucar的體外熒光成像(B) 分別在Eug通道和FITC通道下口服FITC、Eug或Eug-FITC@Fucar(等量FITC或Eug) 0、1、2、4、6和24小時小鼠主要器官(心、肝、脾、肺、腎和胃腸道)的代表性熒光圖像。(C) Eug通道和(D) FITC通道下各時間點的熒光定量。(E) 小鼠灌胃后。Eug 、FITC和Eug-FITC@Fucar后同一位置腸道組織冷凍切片的代表性熒光圖像。(F) 灌胃Eug-Col@Fucar后小鼠腸道組織代表性SEM(下)和偽彩色SEM(上)圖像。(G) 小鼠胃腸道不同部位內容物代表性亮場顯微鏡圖像(上)、熒光圖像(中)和SEM圖像(下)。
(5)Eug-Col@Fucar治療急性痛風性關節炎的療效
Eug-Col@Fucar在高尿酸血癥(HUA)誘導的痛風性關節炎(GA)小鼠模型中表現出了顯著的治療效果。與模型組相比,Eug-Col@Fucar組在減輕關節腫脹、緩解機械性痛覺過敏、改善步態以及減輕骨損傷方面表現更為顯著。特別是,Eug-Col@Fucar組在48小時后,關節腫脹程度與對照組相近,遠優于單獨使用Eug、Col和Fucar的組。此外,Eug-Col@Fucar組的尿酸水平顯著低于模型組,而Col組的尿酸水平未能顯著降低。Eug-Col@Fucar通過持續釋放Eug和Col,有效減輕了由MSU結晶引起的痛風性關節炎的癥狀,并改善了小鼠的步態障礙。Micro CT分析顯示,Eug-Col@Fucar組在關節骨損傷方面明顯優于模型組,證明其具有保護骨骼的作用。總的來說,Eug-Col@Fucar不僅能夠降低血清尿酸濃度,還能減輕關節炎癥、緩解痛感、改善步態障礙,并具有潛力作為治療痛風性關節炎的雙重療法。
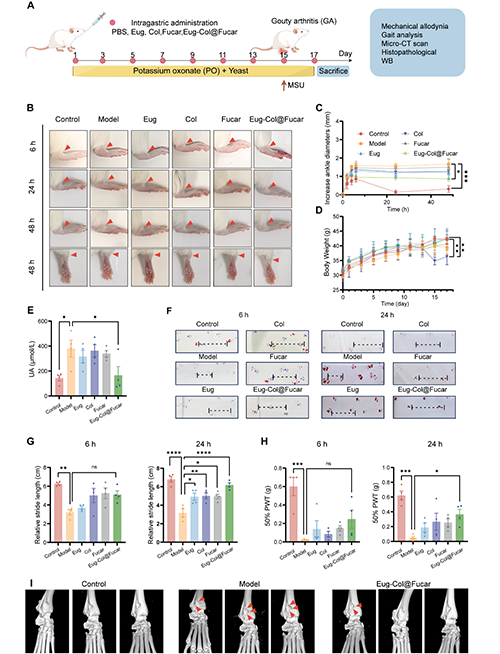 圖5. Eug-Col@Fucar對MSU誘導GA伴HUA的治療作用。(A) 治療過程示意圖。(B) 注射后6、24、48 h,不同治療組GA小鼠右腳踝代表性照片。(C) PBS、Eug、Col、Fucar和Eug-Col@Fucar在關鍵時間點(2、4、6、24和48 h) GA小鼠關節直徑的變化。(D) 處理期間小鼠體重。(E) 用Eug、Col、Fucar和Eug-Col@Fucar處理的HUA小鼠血清UA水平。(F) 不同組分別在6 h和24 h的步態分析結果。虛線表示步幅。(G) 定量分析不同組痛風性關節炎小鼠在6 h和24 h時的相對步長。(H) 對照組、模型組、Eug組、Col組、Fucar組和Eug-Col@Fucar組50% PWT分別在6 h和24 h時的變化。(I) 對照組、模型組和Eug-Col@Fucar組踝關節代表性顯微CT圖像。
圖5. Eug-Col@Fucar對MSU誘導GA伴HUA的治療作用。(A) 治療過程示意圖。(B) 注射后6、24、48 h,不同治療組GA小鼠右腳踝代表性照片。(C) PBS、Eug、Col、Fucar和Eug-Col@Fucar在關鍵時間點(2、4、6、24和48 h) GA小鼠關節直徑的變化。(D) 處理期間小鼠體重。(E) 用Eug、Col、Fucar和Eug-Col@Fucar處理的HUA小鼠血清UA水平。(F) 不同組分別在6 h和24 h的步態分析結果。虛線表示步幅。(G) 定量分析不同組痛風性關節炎小鼠在6 h和24 h時的相對步長。(H) 對照組、模型組、Eug組、Col組、Fucar組和Eug-Col@Fucar組50% PWT分別在6 h和24 h時的變化。(I) 對照組、模型組和Eug-Col@Fucar組踝關節代表性顯微CT圖像。
(6)對MSU誘導的氧化應激和NLRP3介導的體內炎癥的抑制作用
Eug-Col@Fucar的抗炎效果:Eug-Col@Fucar顯著減少了痛風性關節炎(GA)小鼠模型中關節的中性粒細胞和M1型巨噬細胞的數量,表現出強大的抗炎潛力。與模型組相比,Eug-Col@Fucar組在減輕炎癥和細胞浸潤方面效果顯著。Eug-Col@Fucar通過顯著減少NLRP3炎癥小體的表達,抑制了MSU結晶引起的炎癥反應。Western blot分析顯示,Eug-Col@Fucar顯著降低了NLRP3、活化的Caspase-1、ASC和IL-1β的過度表達,證明其對NLRP3炎癥小體的抑制作用。
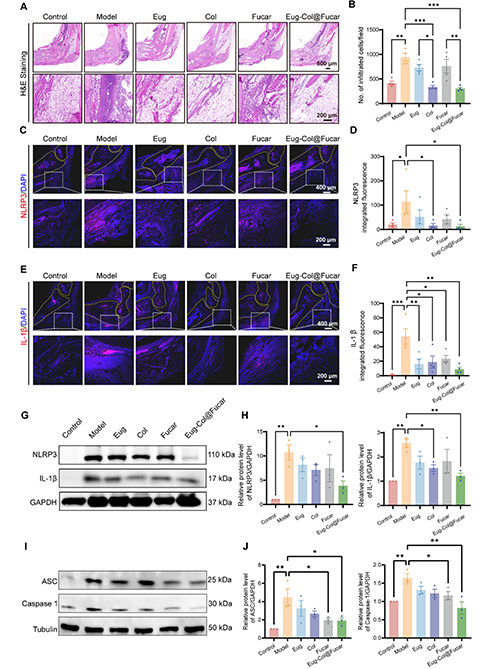 圖6. Eug-Col@Fucar對踝關節的抗炎作用。(A) 低倍放大(上)和高倍放大(下)踝關節H&E染色。(B)每個觀察場浸潤炎性細胞數的陽性分析。(C) 低(上)和高(下)放大下踝關節NLRP3的免疫熒光染色。(D) 踝關節NLRP3熒光定量分析。(E)低倍放大(上)和高倍放大(下)踝關節IL-1β免疫熒光染色。(F) 踝關節組織IL-1β熒光定量分析。(G) 不同處理后踝關節組織NLRP3和IL-1β水平的Western blot分析。(H) 踝關節組織中IL-1β和NLRP3蛋白水平的定量分析。(I) 不同處理后踝關節組織中ASC和Caspase 1蛋白水平的Western blot分析。(J) 踝關節組織中ASC和Caspase 1蛋白水平的定量分析。
圖6. Eug-Col@Fucar對踝關節的抗炎作用。(A) 低倍放大(上)和高倍放大(下)踝關節H&E染色。(B)每個觀察場浸潤炎性細胞數的陽性分析。(C) 低(上)和高(下)放大下踝關節NLRP3的免疫熒光染色。(D) 踝關節NLRP3熒光定量分析。(E)低倍放大(上)和高倍放大(下)踝關節IL-1β免疫熒光染色。(F) 踝關節組織IL-1β熒光定量分析。(G) 不同處理后踝關節組織NLRP3和IL-1β水平的Western blot分析。(H) 踝關節組織中IL-1β和NLRP3蛋白水平的定量分析。(I) 不同處理后踝關節組織中ASC和Caspase 1蛋白水平的Western blot分析。(J) 踝關節組織中ASC和Caspase 1蛋白水平的定量分析。
(7)對秋水仙堿相關不良反應的保護作用
Col的毒性與副作用:Col的治療劑量接近其毒性劑量,最常見的毒性表現為胃腸道副作用,如惡心、嘔吐和腹瀉。在GA治療過程中,Col處理的小鼠體重顯著下降,這可能與其毒性相關。Col處理導致胃和肝臟的器官指數顯著增加,提示可能引起胃和肝臟組織的病理改變。而在將Col與Fucar共同封裝形成Eug-Col@Fucar后,這兩者的器官指數恢復正常,表明Eug-Col@Fucar能夠減輕Col對胃和肝臟的損傷。Col處理導致結腸長度縮短,并顯著減少了緊密連接蛋白Occludin、Claudin-1和ZO-1的表達,表明Col可能損害了腸道屏障功能。而Eug-Col@Fucar能夠顯著恢復這些緊密連接蛋白的表達,修復腸道屏障功能。Col組的小鼠胃粘膜上皮細胞喪失,結腸組織的杯狀細胞分泌減少,導致結腸屏障通透性增加。此外,Col處理還導致肝細胞輕微的顆粒變形和細胞質松弛。通過HE染色可以看到,Col引起的這些胃腸道和肝臟損傷在Eug-Col@Fucar的治療下得到了明顯改善。
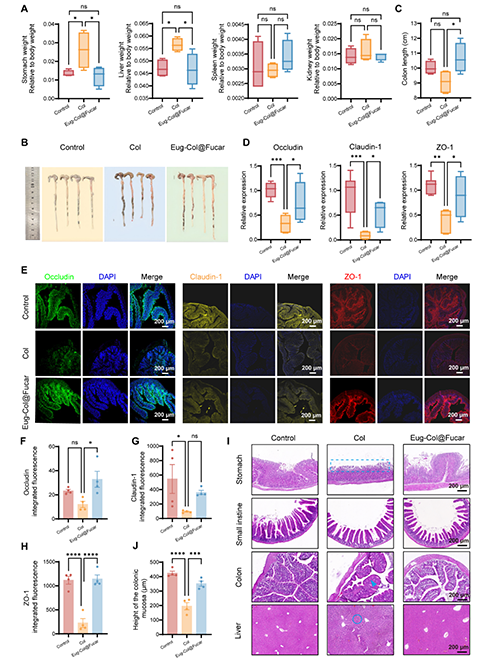 圖7. Eug-Col@Fucar減少秋水仙堿的胃腸道副作用。(A)在Control、Col、和Eug-Col@Fucar組的主要器官的器官指數,包括肝、胃、脾、腎。(B)不同組小鼠盲腸和結腸組織中的解剖照片。(C) 結腸長度定量。(D) RT-qPCR 分析Occludin, Claudin-1,和ZO-1表達水平。(E) ,不同組小鼠結腸組織Occludin(綠色)的Claudin-1(黃色)和ZO-1(紅色)的熒光圖片。不同處理后結腸組織(F) Occludin、(G) Claudin-1、(H) ZO-1熒光定量分析。(I) Control組、Col組、Eug-Col@Fucar組結腸黏膜高度定量分析(n = 4)。(J)不同組胃、小腸、結腸、肝臟組織代表性H&E染色圖像。
圖7. Eug-Col@Fucar減少秋水仙堿的胃腸道副作用。(A)在Control、Col、和Eug-Col@Fucar組的主要器官的器官指數,包括肝、胃、脾、腎。(B)不同組小鼠盲腸和結腸組織中的解剖照片。(C) 結腸長度定量。(D) RT-qPCR 分析Occludin, Claudin-1,和ZO-1表達水平。(E) ,不同組小鼠結腸組織Occludin(綠色)的Claudin-1(黃色)和ZO-1(紅色)的熒光圖片。不同處理后結腸組織(F) Occludin、(G) Claudin-1、(H) ZO-1熒光定量分析。(I) Control組、Col組、Eug-Col@Fucar組結腸黏膜高度定量分析(n = 4)。(J)不同組胃、小腸、結腸、肝臟組織代表性H&E染色圖像。
(8)調節膽汁酸代謝
Col(生物堿)通過影響膽汁酸的代謝,引起了肝臟損傷和膽汁淤積。Col治療導致膽汁酸的積累,特別是石膽酸(LCA)和牛磺酸鞘磷脂酸鈉(TCA)的水平顯著增加,這與肝毒性相關。LCA在體內過量時,能夠干擾膽汁酸的轉運,導致膽汁酸在肝臟中的積累,從而引發肝臟損傷。
然而,Eug-Col@Fucar(由Fucar和Eug組成的復合物)能夠部分緩解Col引起的膽汁淤積。Eug-Col@Fucar通過調節膽汁酸相關受體的表達,促進膽汁酸代謝,改善膽汁酸的分泌,減輕肝臟損傷。因此,Eug-Col@Fucar在調節膽汁酸代謝和改善肝功能方面顯示出一定的治療潛力。
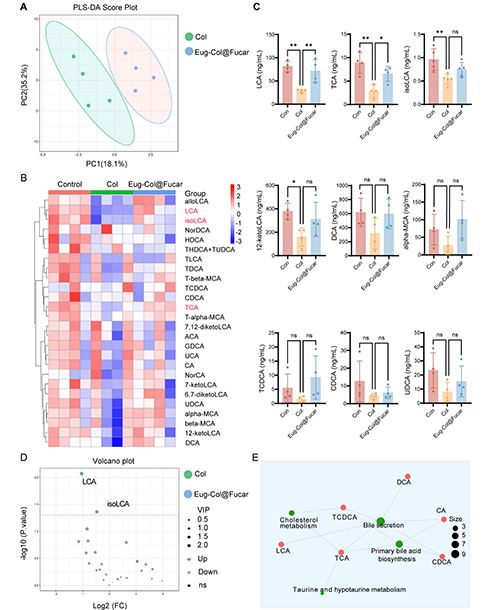 圖8. Eug-Col@Fucar恢復膽汁酸代謝物譜。(A) Control組、Col組和Eug-Col@Fucar組的PLS-DA評分圖。(B) 不同組膽汁酸相對豐度的群落熱圖分析。(C) 不同組糞便中LCA、TCA、α - mca、isoLCA、12-ketoLCA、DCA、TDCA、CDCA和UDCA的濃度。(D) 火山圖反映了Col組和Eug-Col@Fucar組之間代謝物的差異。(E) 對照組、Col組和Eug-Col@Fucar組差異代謝物的KEGG通路富集分析。
圖8. Eug-Col@Fucar恢復膽汁酸代謝物譜。(A) Control組、Col組和Eug-Col@Fucar組的PLS-DA評分圖。(B) 不同組膽汁酸相對豐度的群落熱圖分析。(C) 不同組糞便中LCA、TCA、α - mca、isoLCA、12-ketoLCA、DCA、TDCA、CDCA和UDCA的濃度。(D) 火山圖反映了Col組和Eug-Col@Fucar組之間代謝物的差異。(E) 對照組、Col組和Eug-Col@Fucar組差異代謝物的KEGG通路富集分析。
(9)調節膽汁酸代謝
通過口服給藥Eug、Col、Fucar和Eug-Col@Fucar,并進行血液和組織學分析,研究評估了體內生物相容性。各組的常規血液分析參數均在正常范圍內,治療組與健康對照組之間沒有顯著差異。然而,Col組在兩個肝功能指標(TBA和ALT)上出現了顯著差異,特別是TBA含量的增加與膽汁酸代謝分析的結果一致,表明長期使用Col可能導致膽汁酸在肝臟中的積累。此外,心臟、脾臟、肺和腎臟的組織切片中未發現明顯的損傷或病理變化。Col組肝臟出現輕度的肝細胞水腫和變性,而其他組的肝臟未見明顯病理變化。結果表明,Fucar二元多糖水凝膠能夠有效減少Col的長期毒性。
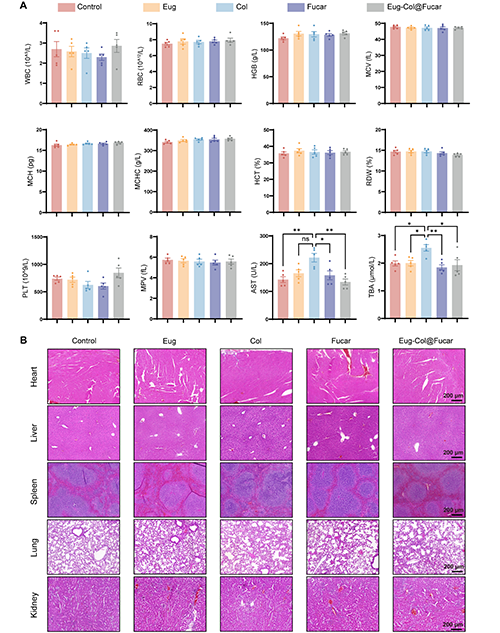 圖9. 口服生物安全性評價Eug-Col@Fucar。(A)不同處理后小鼠血常規及生化分析(n = 5)。白細胞(WBC);紅細胞;血紅蛋白,血紅蛋白;MCV,平均細胞體積;MCH,平均紅細胞血紅蛋白;MCHC,平均紅細胞血紅蛋白濃度;HCT、血細胞比容;RDW,紅細胞分布寬度;PLT:血小板;MPV,平均血小板體積;TBA:總膽汁酸;谷草轉氨酶。(B)主要臟器(心、肝、脾、肺、腎)的H&E染色。
圖9. 口服生物安全性評價Eug-Col@Fucar。(A)不同處理后小鼠血常規及生化分析(n = 5)。白細胞(WBC);紅細胞;血紅蛋白,血紅蛋白;MCV,平均細胞體積;MCH,平均紅細胞血紅蛋白;MCHC,平均紅細胞血紅蛋白濃度;HCT、血細胞比容;RDW,紅細胞分布寬度;PLT:血小板;MPV,平均血小板體積;TBA:總膽汁酸;谷草轉氨酶。(B)主要臟器(心、肝、脾、肺、腎)的H&E染色。
本研究成功開發了Eug-Col@Fucar水凝膠系統,該系統利用Fucar載載Eug-Col復合物。該水凝膠系統有效減少了細胞毒性,清除自由基和活性氧,促進了細胞向M2型抗炎表型的極化,并抑制了炎癥因子的釋放。此外,Eug-Col@Fucar水凝膠通過在腸道環境中持續釋放藥物,顯著提高了藥物的口服生物利用度。同時,Eug-Col@Fucar通過抑制NLRP3-IL1β途徑,穩定并增強了抗炎效果。因此,重編程的抗炎微環境有效抑制了炎癥反應,緩解了GA小鼠的踝關節腫脹和關節疼痛。此外,Eug-Col@Fucar有效緩解了Col引起的胃腸副作用,如胃腸組織緊密連接受損和胃絨毛喪失。由于其富含多糖的組成,Eug-Col@Fucar水凝膠系統還改善了膽汁酸代謝,從而減輕了Col引起的肝毒性。除了顯著的療效外,Eug-Col@Fucar還表現出優異的生物安全性,適合長期應用。總之,本研究開發了一種新型水凝膠遞送系統,能夠增強藥物在GA治療中的療效,同時減輕Col長期臨床應用所帶來的不良反應。Eug-Col@Fucar為GA治療提供了一種有前景的策略,并具有廣泛的臨床應用潛力。
論文第一作者為浙江大學博士生劉笑陽和浙江大學愛丁堡大學聯合學院博士后董佳,浙江大學周民教授為論文的通訊作者。上述研究得到了國家重點研發計劃項目、浙江省領軍創新創業團隊引進計劃等基金項目的大力支持。
全文鏈接:https://www.sciencedirect.com/science/article/pii/S2452199X25002154
針對上述問題,浙江大學州民教授團隊開發了一種基于開發了一種基于裸藻(Eug)、秋水仙堿(Col)和巖藻糖卡拉膠復合物(Fucar)的口服水凝膠系統(Eug-Col@Fucar) 將裸藻的尿酸吸附特性、巖藻糖卡拉膠復合物的腸道保護功能與秋水仙堿的抗炎作用有機結合。首次實現了"降尿酸-抗炎-消化系統保護"三位一體協同治療,為痛風患者提供了更安全高效的治療方案。實驗結果表明,Eug-Col@Fucar能有效降低血清尿酸水平,清除自由基和活性氧(ROS),促進巨噬細胞向M2型抗炎表型極化,抑制NLRP3-IL-1β信號通路,從而改善痛風性關節炎。此外,該系統顯著緩解了秋水仙堿引起的胃腸道不良反應,如胃腸絨毛結構異常和屏障通透性增加等問題。由于富含多糖成分,該水凝膠系統還能改善膽汁酸代謝,從而減輕秋水仙堿誘導的肝毒性。此外,安全性評估也證實了該復合物的良好生物相容性,為未來臨床應用奠定了基礎。

該文章近期以《Microalgae-based hydrogel drug delivery system for treatment of gouty arthritis with alleviated colchicine side effects》為題發表于《Bioactive Materials》上。

(1)Eug-Col@Fucar的合成和表征
本研究開發了一種Eug-Col@Fucar水凝膠系統,用于共同傳遞Eug和Col,制得了更加穩定和均勻的制劑。該水凝膠通過將巖藻糖(Fuc)與不同濃度的卡拉膠(Car)混合,誘導凝膠化。結果表明,隨著卡拉膠濃度的增加,水凝膠展現了良好的剪切變稀特性和可注射性,并且凝膠的彈性得到了顯著增強。掃描電子顯微鏡(SEM)圖像顯示,巖藻糖和卡拉膠通過協同作用形成了致密的凝膠網絡,且隨著卡拉膠濃度的增加,凝膠孔徑減小,從而提高了凝膠的強度和穩定性。Eug-Col復合物成功地被包載進Fucar水凝膠中,并且在加載后水凝膠呈現綠色,顯示出優良的可注射性。體外藥物釋放實驗表明,Eug-Col@Fucar能夠有效保護Col免受胃酸的降解,允許在小腸中進行控制釋放,從而提高了Col的生物利用度并減少了胃腸道毒性。總體來說,Fucar水凝膠系統對于Eug和Col的口服遞送是一個有效的載體。

(2)Eug-Col@Fucar的體外生物相容性及抗氧化作用
Eug(一種富含抗氧化成分的微藻)與Col(治療痛風的臨床藥物)在Fucar水凝膠載體中協同作用,能夠顯著增強細胞活力,并減輕Col的細胞毒性。Eug和Fucar顯示了良好的生物兼容性,并促進了細胞的增殖。Eug在清除自由基方面表現優異,并與Col一起對抗氧化應激提供保護。此外,Eug-Col@Fucar系統在體外實驗中有效地清除了過氧化氫和自由基,且在LPS誘導的氧化應激中顯著減少了ROS的生成,表現出較強的抗氧化作用。總體而言,Eug-Col@Fucar不僅具有較強的抗氧化能力,還能夠有效減少氧化損傷,具有在治療炎癥性疾病中的應用前景。

(3)Eug-Col@Fucar巨噬細胞重編程和體外抗炎能力的研究
Eug-Col@Fucar系統在治療痛風性關節炎(GA)中具有潛力。研究表明,Eug-Col@Fucar能夠顯著誘導小鼠巨噬細胞從M1型(促炎性)轉變為M2型(抗炎性),并且通過這種轉化有效地抑制了炎癥反應。實驗中,Eug-Col@Fucar顯著提高了M2型巨噬細胞的比例,減少了M1型巨噬細胞的比例,從而降低了與痛風相關的炎癥因子(如TNF-α、IL-6、IL-1β)的表達。與Eug、Col、Fucar單獨處理相比,Eug-Col@Fucar表現出更強的抗炎作用,能夠有效抑制M1型標志基因的表達,并增強M2型標志基因的表達。因此,Eug-Col@Fucar系統能夠有效重編程巨噬細胞,轉化為抗炎性的M2型巨噬細胞,為痛風性關節炎的治療提供了一種理想的生物材料。

(4)Eug-Col@Fucar的熒光成像性質及生物分布
Eug-Col@Fucar在口服給藥后的生物分布研究表明,該復合材料能夠有效延長藥物在體內的滯留時間,促進藥物的吸收并增強治療效果。通過熒光成像觀察發現,Eug-Col@Fucar主要分布在小腸,尤其是回腸,并且在24小時內,Eug-Col@Fucar在小腸的熒光信號強度和持續時間顯著高于自由的Eug和Col。此外,未在主要器官(如心臟、肝臟、脾臟、肺和腎臟)中檢測到Eug積聚,說明Eug-Col@Fucar在口服后主要在胃腸道內發揮作用。通過定量分析發現,雖然Fucar涂層使FITC的熒光強度有所降低,但Eug-Col@Fucar組在24小時后的信號更為顯著,表明Col的滯留時間得到了延長。凍切片的腸道組織進一步證明了Eug-Col@Fucar能夠有效地保持Eug和Col的熒光信號,且與單獨使用Eug和Col的組相比,表現出更強的熒光。在降解過程方面,Eug-Col@Fucar在胃腸道內表現出優異的生物降解性。其在小腸和盲腸逐漸解體,到達結腸時幾乎完全降解,證明了其良好的生物可降解性。綜上所述,Eug-Col@Fucar能夠有效延長藥物在體內的滯留時間,增強藥物吸收,并且具有優異的生物降解性,顯示出其作為口服給藥系統的潛力。

(5)Eug-Col@Fucar治療急性痛風性關節炎的療效
Eug-Col@Fucar在高尿酸血癥(HUA)誘導的痛風性關節炎(GA)小鼠模型中表現出了顯著的治療效果。與模型組相比,Eug-Col@Fucar組在減輕關節腫脹、緩解機械性痛覺過敏、改善步態以及減輕骨損傷方面表現更為顯著。特別是,Eug-Col@Fucar組在48小時后,關節腫脹程度與對照組相近,遠優于單獨使用Eug、Col和Fucar的組。此外,Eug-Col@Fucar組的尿酸水平顯著低于模型組,而Col組的尿酸水平未能顯著降低。Eug-Col@Fucar通過持續釋放Eug和Col,有效減輕了由MSU結晶引起的痛風性關節炎的癥狀,并改善了小鼠的步態障礙。Micro CT分析顯示,Eug-Col@Fucar組在關節骨損傷方面明顯優于模型組,證明其具有保護骨骼的作用。總的來說,Eug-Col@Fucar不僅能夠降低血清尿酸濃度,還能減輕關節炎癥、緩解痛感、改善步態障礙,并具有潛力作為治療痛風性關節炎的雙重療法。

(6)對MSU誘導的氧化應激和NLRP3介導的體內炎癥的抑制作用
Eug-Col@Fucar的抗炎效果:Eug-Col@Fucar顯著減少了痛風性關節炎(GA)小鼠模型中關節的中性粒細胞和M1型巨噬細胞的數量,表現出強大的抗炎潛力。與模型組相比,Eug-Col@Fucar組在減輕炎癥和細胞浸潤方面效果顯著。Eug-Col@Fucar通過顯著減少NLRP3炎癥小體的表達,抑制了MSU結晶引起的炎癥反應。Western blot分析顯示,Eug-Col@Fucar顯著降低了NLRP3、活化的Caspase-1、ASC和IL-1β的過度表達,證明其對NLRP3炎癥小體的抑制作用。

(7)對秋水仙堿相關不良反應的保護作用
Col的毒性與副作用:Col的治療劑量接近其毒性劑量,最常見的毒性表現為胃腸道副作用,如惡心、嘔吐和腹瀉。在GA治療過程中,Col處理的小鼠體重顯著下降,這可能與其毒性相關。Col處理導致胃和肝臟的器官指數顯著增加,提示可能引起胃和肝臟組織的病理改變。而在將Col與Fucar共同封裝形成Eug-Col@Fucar后,這兩者的器官指數恢復正常,表明Eug-Col@Fucar能夠減輕Col對胃和肝臟的損傷。Col處理導致結腸長度縮短,并顯著減少了緊密連接蛋白Occludin、Claudin-1和ZO-1的表達,表明Col可能損害了腸道屏障功能。而Eug-Col@Fucar能夠顯著恢復這些緊密連接蛋白的表達,修復腸道屏障功能。Col組的小鼠胃粘膜上皮細胞喪失,結腸組織的杯狀細胞分泌減少,導致結腸屏障通透性增加。此外,Col處理還導致肝細胞輕微的顆粒變形和細胞質松弛。通過HE染色可以看到,Col引起的這些胃腸道和肝臟損傷在Eug-Col@Fucar的治療下得到了明顯改善。

(8)調節膽汁酸代謝
Col(生物堿)通過影響膽汁酸的代謝,引起了肝臟損傷和膽汁淤積。Col治療導致膽汁酸的積累,特別是石膽酸(LCA)和牛磺酸鞘磷脂酸鈉(TCA)的水平顯著增加,這與肝毒性相關。LCA在體內過量時,能夠干擾膽汁酸的轉運,導致膽汁酸在肝臟中的積累,從而引發肝臟損傷。
然而,Eug-Col@Fucar(由Fucar和Eug組成的復合物)能夠部分緩解Col引起的膽汁淤積。Eug-Col@Fucar通過調節膽汁酸相關受體的表達,促進膽汁酸代謝,改善膽汁酸的分泌,減輕肝臟損傷。因此,Eug-Col@Fucar在調節膽汁酸代謝和改善肝功能方面顯示出一定的治療潛力。

(9)調節膽汁酸代謝
通過口服給藥Eug、Col、Fucar和Eug-Col@Fucar,并進行血液和組織學分析,研究評估了體內生物相容性。各組的常規血液分析參數均在正常范圍內,治療組與健康對照組之間沒有顯著差異。然而,Col組在兩個肝功能指標(TBA和ALT)上出現了顯著差異,特別是TBA含量的增加與膽汁酸代謝分析的結果一致,表明長期使用Col可能導致膽汁酸在肝臟中的積累。此外,心臟、脾臟、肺和腎臟的組織切片中未發現明顯的損傷或病理變化。Col組肝臟出現輕度的肝細胞水腫和變性,而其他組的肝臟未見明顯病理變化。結果表明,Fucar二元多糖水凝膠能夠有效減少Col的長期毒性。

本研究成功開發了Eug-Col@Fucar水凝膠系統,該系統利用Fucar載載Eug-Col復合物。該水凝膠系統有效減少了細胞毒性,清除自由基和活性氧,促進了細胞向M2型抗炎表型的極化,并抑制了炎癥因子的釋放。此外,Eug-Col@Fucar水凝膠通過在腸道環境中持續釋放藥物,顯著提高了藥物的口服生物利用度。同時,Eug-Col@Fucar通過抑制NLRP3-IL1β途徑,穩定并增強了抗炎效果。因此,重編程的抗炎微環境有效抑制了炎癥反應,緩解了GA小鼠的踝關節腫脹和關節疼痛。此外,Eug-Col@Fucar有效緩解了Col引起的胃腸副作用,如胃腸組織緊密連接受損和胃絨毛喪失。由于其富含多糖的組成,Eug-Col@Fucar水凝膠系統還改善了膽汁酸代謝,從而減輕了Col引起的肝毒性。除了顯著的療效外,Eug-Col@Fucar還表現出優異的生物安全性,適合長期應用。總之,本研究開發了一種新型水凝膠遞送系統,能夠增強藥物在GA治療中的療效,同時減輕Col長期臨床應用所帶來的不良反應。Eug-Col@Fucar為GA治療提供了一種有前景的策略,并具有廣泛的臨床應用潛力。
論文第一作者為浙江大學博士生劉笑陽和浙江大學愛丁堡大學聯合學院博士后董佳,浙江大學周民教授為論文的通訊作者。上述研究得到了國家重點研發計劃項目、浙江省領軍創新創業團隊引進計劃等基金項目的大力支持。
全文鏈接:https://www.sciencedirect.com/science/article/pii/S2452199X25002154
版權與免責聲明:中國聚合物網原創文章。刊物或媒體如需轉載,請聯系郵箱:info@polymer.cn,并請注明出處。
(責任編輯:xu)
相關新聞
- 浙江大學周民團隊《Adv. Drug Deliver. Rev.》:光敏性微藻在靶向腫瘤治療中的應用 2025-02-23
- 浙江大學周民團隊《Adv. Sci.》:新型微藻生物系統結合納米刀技術用于肝癌免疫治療 2025-02-10
- 浙江大學周民團隊《Nano Today》:微藻藥物遞送微球系統用于治療高尿酸血癥并伴有腎損傷 2025-01-06
- 蘇大劉莊/楊光保教授團隊招聘博士后 - 材料合成、納米醫學(腫瘤診療、藥物遞送、免疫治療等) 2025-04-29
- 四川大學楊佼佼/熊燕/李繼遙 Acta Biomater.: 用于減輕化膿性關節炎影像學和病理學損傷的原位雙靶向藥物遞送系統 2025-02-15
- 東華大學史向陽教授團隊 Nano Today:基于含磷樹狀大分子的藥物遞送系統協同增強自噬、抗炎和抗氧化治療阿爾茨海默癥 2025-02-11
- 西南醫大口腔醫院陶剛/黎春暉/蔡蕊團隊:具有ROS觸發藥物釋放特性的可注射水凝膠實現抗菌劑和抗炎納米顆粒協同遞送用于牙周炎治療 2025-04-15
