植入式深腦探針(DBPs)是腦機接口的核心組件,但其面臨兩大瓶頸:傳統剛性材料(如硅、金屬)與腦組織模量失配引發免疫排斥,而柔性水凝膠材料因加工工藝限制難以實現多模態功能集成。如何開發兼具力學相容性與多功能性的新型探針,成為破解神經退行性疾病治療難題的關鍵。
近日,四川大學與新加坡國立大學團隊開發了一種水凝膠基多功能復合探針(HybF),通過濕紡工藝與離子螯合/解螯合技術,將導電、導光和藥物遞送纖維模塊集成于PLGA基絕緣殼層中,實現了大鼠深部腦區的精準干預。相關成果以“Hydrogel-Based Multifunctional Deep Brain Probe for Neural Sensing, Manipulation, and Therapy”為題發表于ACS Nano(DOI: 10.1021/acsnano.5c03865)。
1.自適應力學性能的水凝膠纖維設計。HybF采用海藻酸鈉/MXene導電水凝膠芯層與PLGA/MgO絕緣外殼的復合結構,基于多糖和MXene材料的超強親水性實現HybF的干濕態剛度切換:干燥態下HybF的彎曲剛度約1 N/m,滿足植入時的機械支撐需求,濕潤態下HybF的彎曲剛度降至0.3 N/m(圖1d),PLGA殼層的kPa級力學模量(圖1e)也與腦組織模量相接近(0.1–1 kPa);上述設計解決了傳統深腦探針“植入剛性不足”與“長期植入力學失配”的矛盾。

圖1.多功能HybF的設計、制造和表征。
2.HybF導電、導光、導藥的多模態功能集成及抗癲癇治療的體內驗證。高分辨電信號記錄:MXene通過多重氫鍵相互作用與基質海藻酸鈉纖維結合搭建三維導電網絡,導電纖維模塊阻抗低至97 S/m(1 kHz),可捕捉單個神經元動作電位(圖2j);光遺傳學調控:PEGDA水凝膠光纖模塊透光率超90%(400–900 nm),635 nm光照通過HybF成功誘導hSyn-ChrimsonR轉基因大鼠海馬神經元放電(圖2i),主成分分析(PCA)清晰區分光刺激前后的放電模式(圖2k),同時重復光照可誘導癲癇樣放電,驗證了HybF的神經調控精度(圖2l);時空可控藥物遞送: 在KA誘導的慢性癲癇大鼠模型中,中空纖維模塊實現5-氨基酮戊酸(5-ALA)的局部釋放,聯合635 nm光照觸發光動力效應,在癲癇大鼠模型中使異常放電幅值降低83%(圖3i),同時治療區域僅限光照靶點,未觀察到鄰近腦組織損傷,水迷宮實驗顯示HybF基光動力療法后大鼠認知功能保留率超90%(圖4a,b)。
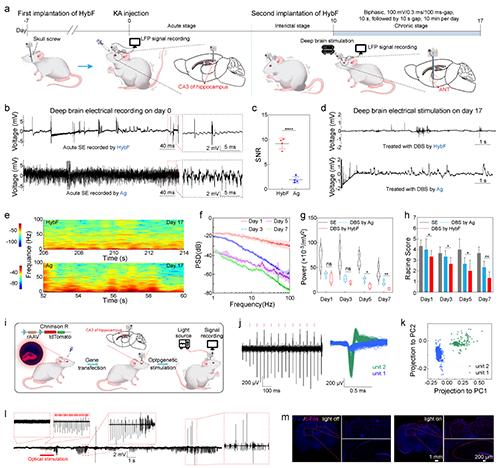
圖2. HybF介導的深部腦刺激的功能驗證。(深腦電刺激與深腦光刺激)
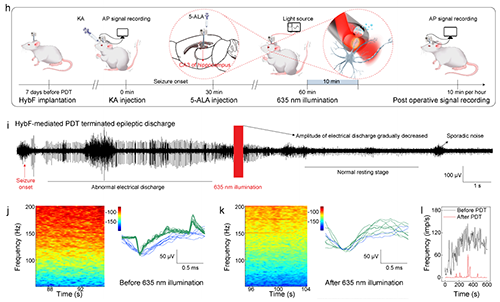
圖3. HybF介導的深部腦記錄和光動力療法治療癲癇。
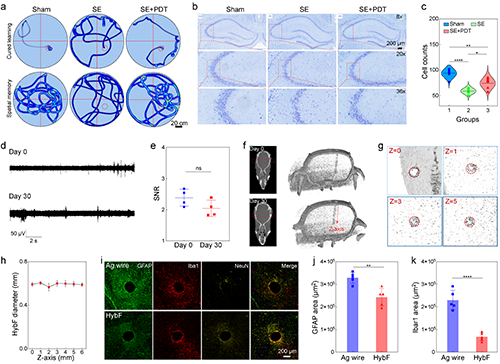
圖4. HybF植入后的術后效果和生物相容性評價。
該研究首次實現水凝膠基深腦探針在深部腦干預中的多模態應用,其核心優勢包括:基于海藻酸/MXene/PLGA的全降解體系,兼具力學匹配與功能集成;濕紡工藝支持規模化生產,HybF直徑(約500 μm)適配現有植入器械;有望為癲癇、帕金森病等疾病提供臨床“診斷-治療-監測”一體化方案。
文章第一作者為四川大學博士研究生陳志鴻,通訊作者為新加坡國立大學Chwee Teck Lim教授與四川大學范紅松教授。該研究獲國家自然科學基金(32361133548, 52303195)、四川省科技廳項目(2024NSFSC1014)資助。
原文鏈接:https://doi.org/10.1021/acsnano.5c03865
- 浙大傅國勝/黃翯/趙靜《ACS Nano》:可噴涂微環境響應型水凝膠涂層重塑內皮屏障穩態,破解介入后再狹窄難題 2025-06-04
- 青島大學于冰教授團隊 Small:具有快速止血和廣譜抗菌特性的寡肽水凝膠用于加速傷口愈合 2025-06-03
- 北理工賀志遠教授團隊 Nat. Commun.: 新型結冰預警水凝膠器件在防/除冰領域的突破性研究 2025-05-29
- 華南理工鄭大鋒教授、廣東工大邱學青教授團隊 ACS Nano:多功能全生物質雙層氣凝膠用于高效太陽能驅動海水淡化和熱電生產 2025-05-30
- 福州大學賴躍坤教授等 Prog. Mater. Sci. 綜述:用于醫療健康的多功能柔性器件的材料、結構設計及性能研究 2025-05-30
- 港中大(深圳)趙征 / 唐本忠團隊 ACS Nano :多功能AIE納米馬達突破腫瘤屏障 - 實現精準光診療 2025-05-29
