骨骼肌的損傷十分常見,如肌中毒、過高或過低的溫度、創(chuàng)傷性損傷以及先天性殘疾、退行性肌病等。肌肉自發(fā)修復需要耗費較長的恢復時間且效果有限,手術(shù)植入組織工程構(gòu)建體的方法一般具有較大的創(chuàng)傷性并容易帶來副作用,而微創(chuàng)性直接注射細胞進行修復的方法則面臨所注射細胞從理想的作用位點高度遷移、存活率低等問題,修復效果不理想。
華僑大學陳愛政教授課題組和哈佛醫(yī)學院Yu Shrike Zhang(張宇)教授課題組以聚乳酸羥基乙酸(poly(lactic-co-glycolic acid), PLGA)為原料,通過微流控技術(shù)制備高度貫通多孔微載體(highly open porous microspheres, HOPMs),并通過Minitab全因子實驗設計方案,考察結(jié)果表明聚合物濃度、致孔劑濃度對微載體粒徑和孔徑的影響顯著;而水油比對微載體粒徑和孔徑的影響不顯著。另外,結(jié)果表明微流控技術(shù)制備微載體過程,受到水-油界面張力和連續(xù)相流體剪切力的共同作用。通過改變針頭尺寸、乳化功率和連續(xù)相/分散相流速比,可成功地制備參數(shù)可控的可注射型微載體。

圖1. 不同制備工藝下制備的PLGA LPMs掃描電鏡圖
為考察所制備的HOPMs能否有效地作為C2C12細胞運載體,對比了靜態(tài)培養(yǎng)以及三維微重力培養(yǎng),結(jié)果表面其能很好地支持細胞黏附、增殖和生長。隨著培養(yǎng)時間的延長,C2C12細胞在微載體上具有較高的黏附率,且動態(tài)培養(yǎng)方式較靜態(tài)培養(yǎng)方式有更高的黏附率。說明微載體的預處理過程增加了蛋白質(zhì)的吸附量,改善了PLGA微載體的疏水性,并能較好的模擬生物體內(nèi)的三維生長環(huán)境,有利于營養(yǎng)物質(zhì)、氧氣和代謝廢物等傳質(zhì),介導后續(xù)C2C12細胞的黏附。同時,通過激光共聚焦顯微鏡層掃疊加圖可以看出,HOPMs接種細胞并體外培養(yǎng)3天后,大部分細胞黏附在微載體表面,其內(nèi)部細胞較少。但當接種時間延長到12天時,細胞占據(jù)整個微載體,并且微載體表面的孔結(jié)構(gòu)完全被C2C12細胞分泌的細胞外基質(zhì)所覆蓋。在分子水平檢測表明,復合體在體外在連續(xù)培養(yǎng)20天后,MyoD1、Myf 5及Pax7等成肌相關(guān)的分子標志表達相對較高,說明HOPMs具有較強的誘導肌向分化的能力以及優(yōu)異的成肌性能。

圖2. (A-i)HOPMs與C2C12共培養(yǎng)后在不同時間段的CLSM 圖,靜態(tài)培養(yǎng)和動態(tài)培養(yǎng)不同時間的細胞粘附率(A-ii)及細胞增值率(A-iii)。(B)細胞裝載HOPMs培養(yǎng)不同時間后的CLSM層掃疊加圖。(C)細胞裝載HOPMs的免疫熒光染色圖。(D)細胞裝載HOPMs的H&E染色圖。(E)細胞裝載HOPMs的MyoD1、Myf 5及Pax 7的特性表達水平。
為進一步實驗該高度貫通多孔微載體用于骨骼肌細胞微創(chuàng)原位遞送的可行性,將細胞裝載的HOPMs皮下注射入正常裸鼠體內(nèi),并研究其體內(nèi)增殖和分化情況。相較于直接注射細胞而言,HOPMs可以更好地固定細胞,避免細胞從靶向部位遷移。從H&E染色、Masson染色可以觀察到HOPMs注射部位形成有序、密集的肌肉束結(jié)構(gòu),同時細胞凋亡檢測說明HOPMs具有很好的生物相容性。

圖3. 細胞裝載HOPMs的體內(nèi)療效。(A)裸鼠經(jīng)注射i)生理鹽水,ii)HOPMs微載體懸浮于PBS, iii)懸浮細胞(8×106個/mL)懸浮于PBS,和iv)細胞裝載HOPMs懸浮在PBS一段時間后生長情況照片。(B) H&E染色。(C) Masson染色。(D)治療6周后小鼠移植組織Tunel檢測:i)懸浮細胞(8×106個/mL)懸浮于PBS,ii)細胞裝載HOPMs懸浮于PBS。(E)ACE 2和VEGF-A基因表達。(F)Western blot檢測血管生物標志物(ACE 2,7VEGF-A,GAPDH)。
在組織再生過程中,血管化在其生長中起著關(guān)鍵作用,因為它通過提供所需的營養(yǎng)物質(zhì)、氧氣和清除代謝廢物來維持止血。通過分析血管相關(guān)特異性基因,如血管緊張素轉(zhuǎn)換酶2(ACE 2)和血管緊張素和血管內(nèi)皮生長因子(VEGF-A)可以發(fā)現(xiàn),細胞裝載的HOPMs治療組表現(xiàn)出更高的血管相關(guān)基因表達。H&E染色和Masson染色也顯示HOPMs治療組有微血管在新形成的肌肉組織中向內(nèi)生長。通過肌源性標記物Desmin、MYH1、平滑肌肌動蛋白(SMA)、CD31的免疫組化染色進一步證實成肌細胞的血管化、分化及成熟。
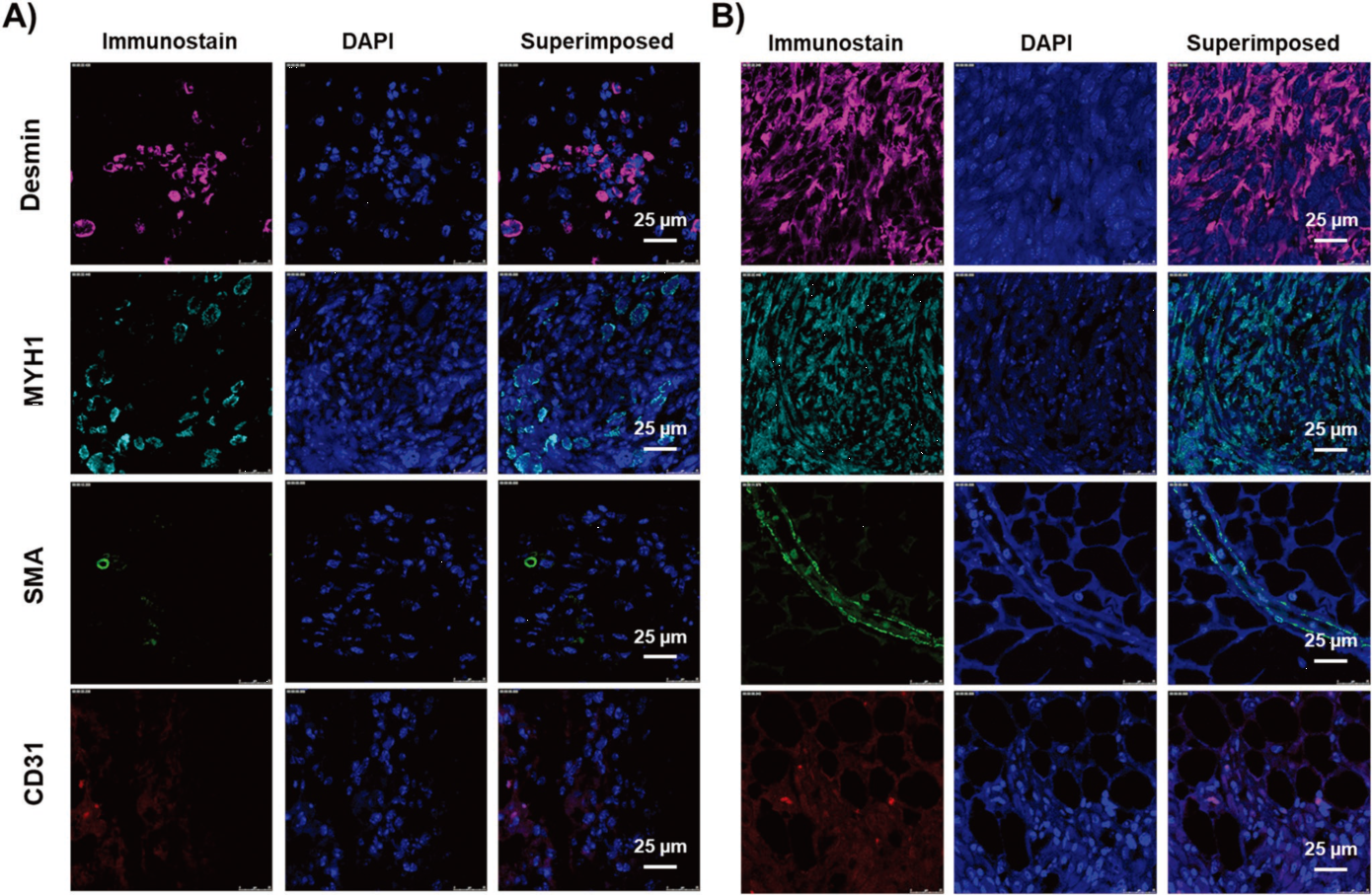
圖4. 免疫組化分析。A)空白組和B)細胞裝載的HOPMs治療組成肌細胞特異性(Desmin,MYH1)和血管特異性標志物(SMA, CD31)免疫組化染色。
綜上所述,該微流控技術(shù)制備高度貫通多孔微載體用于骨骼肌細胞微創(chuàng)原位遞送為修復組織缺損及后續(xù)的肌肉再生研究提供新思路。

以上相關(guān)成果于6月21日正式發(fā)表在Small(DOI:10.1002/smll.201901397),并被選為封面論文(Front cover)。論文共同第一作者為華僑大學生物材料與組織工程研究所Ranjith Kumar Kankala博士和2018屆碩士畢業(yè)生趙佳,通訊作者為哈佛醫(yī)學院張宇(Y. Shrike Zhang)教授和華僑大學陳愛政教授。華僑大學博士生劉晨光、碩士生宋曉杰、王士斌教授和福建醫(yī)科大學楊達云博士、復旦大學中山醫(yī)院朱鎧博士為論文的共同作者。
研究工作得到國家自然科學基金海峽聯(lián)合重點項目《可注射型復合生物支架介導血管化肌組織原位再生的研究》(U1605225)及福建省生物材料科技創(chuàng)新團隊項目的資助。
- 四川大學王云兵教授團隊 Biomaterials:具有免疫逃逸功能的納米載藥涂層 2023-09-16
- 南林黃超伯、寧波材料所陳濤《Adv. Mater.》:生物啟發(fā)的具有可調(diào)螺旋結(jié)構(gòu)的異質(zhì)球體 → 用于準確有效地控制血糖水平 2025-06-18
- 廈門大學侯旭教授團隊 Adv. Mater.:具有外部誘導內(nèi)部微尺度流動的仿生液體囊袋 2025-01-13
- 中國計量大學衛(wèi)國英/吉翠萍 Adv. Sci.:在微流控靜電紡絲技術(shù)制備高效自修復性能的防腐蝕涂層方面取得重要進展 2024-12-31
- 浙工大馮杰/張靜團隊、浙江省人民醫(yī)院周佳 AHM:用于組織修復和預防術(shù)后粘連的“Janus”兩性離子水凝膠貼片 2024-12-10
- 哈工大程鳳/齊大栗洪彬/新國大Tan Swee Ching團隊 AFM:基于靜電紡絲技術(shù)的組織修復支架 2024-12-04
- 曼大李加深團隊 Int. J. Biol. Macromol.:面向骨組織修復的3D聚乳酸多孔纖維海綿 2024-04-23
