與傳統的縫合線或縫合釘相比,使用粘合劑的方法能夠更有效地閉合創口,阻止血液和氣體的泄露。然而,現有的醫用粘合劑不能完全滿足術后要求,例如氰基丙烯酸酯類粘合劑(與502膠水類似)雖然粘接強度高,但是具有一定的細胞毒性且容易形成硬相區域;纖維蛋白類粘合劑雖具有良好的生物相容性,但與組織粘附性弱,不適合用來封堵諸如心血管及肺部等需要承受一定壓力的區域。另一方面,粘合劑在植入人體后,應隨傷口的愈合逐漸降解,避免二次手術。盡管需求明確,但目前仍缺乏同時具有強韌粘接和生物可降解的組織粘接材料。
哈佛大學鎖志剛教授課題組與David Mooney教授提出適用于生物組織的濕表面粘接(Science 2017, 357 (6349), 378-381),實現了水凝膠與生物組織的強韌粘接。該方法以具有良好生物相容性的殼聚糖作為橋接網絡,成功將水凝膠與不同組織形成有效粘接。粘接能(>1000J/m2)遠高于目前商用生物粘合劑(~10 J/m2),甚至能承受遠高于血壓的爆破壓測試。
基于此上研究,他們進一步設計了強韌可降解的水凝膠作為敷料,使用上述粘接技術,實現了同時具有高強度和可降解性的水凝膠-生物組織粘接。
1.降解原理

實現強韌粘接,需要具有良好的粘接層和強韌的敷料材料。研究人員使用強韌的聚丙烯酰胺-海藻酸鈉雙網絡水凝膠作為敷料材料。如圖所示,使用鈣離子Ca2+作為海藻酸鈉交聯點,在體內,由于體液中鹽分與Ca2+發生離子交換進而使得海藻酸鈉網絡降解;使用二硫鍵作為聚丙烯酰胺的交聯點,由于二硫鍵-巰基交換作用使得聚丙烯酰胺網絡降解,人體本身的氨基酸具有巰基(如半胱氨酸)可作為降解材料。
2. 水凝膠本身的降解

研究人員比較了傳統的不可降解韌性水凝膠(交聯劑為N-N’亞甲基雙丙烯酰胺(MBAA))和可降解韌性水凝膠(交聯劑為具有二硫鍵-巰基交換的N-N’雙(丙烯酰)胱胺(BACA)。在模擬體液的作用下,前者仍保持完整形態,而后者完全降解。研究人員進一步研究了物理交聯點(離子交換)和化學交聯點(二硫鍵-巰基交換)破壞對凝膠性能的影響。
3. 降解過程中的粘接性能變化
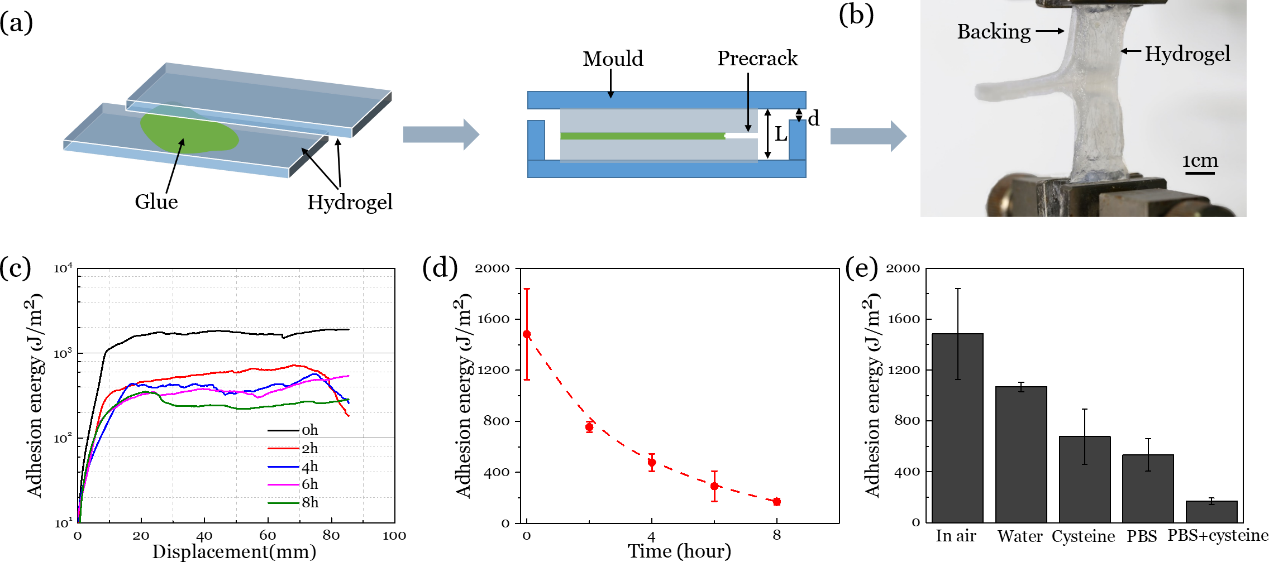
隨著水凝膠的降解,其本體的斷裂韌性降低,導致粘接能隨時間逐漸降低。不同的溶液對于水凝膠的降解效果不同,引起的粘接性能變化也有所不同。
4. 組織粘接

研究人員使用此凝膠實現了與不同生物組織的強韌粘接,且粘接能均超過200 J/m2。與軟骨組織粘接后能承受較大自由拉伸(λ>4),與肺部粘接后能承受超過160 mmHg的水壓。與組織粘接后實現了完全降解,在人體濃度氨基酸作用下,凝膠一個月后失去承載能力。該韌性可降解凝膠設計為生物組織修復提供了一種新材料和設計思路。
該研究工作發表于ACS Applied Bio materials。西安交通大學航天航空學院碩士生楊航為第一作者,西安交通大學青年教師唐敬達與哈佛大學鎖志剛教授為論文共同通訊作者。
論文鏈接:https://pubs.acs.org/doi/abs/10.1021/acsabm.9b00103?from=timeline&isappinstalled=0
- 浙大王征科課題組《Macromol. Rapid Commun.》: 泥鰍粘液-甲基丙烯酰化明膠超潤滑水凝膠 2025-06-30
- 西交大魏釗/北大楊根 Small 綜述: 力學性能可調動態水凝膠用于3D類器官培養 2025-06-27
- 華科大吳豪等 Sci. Adv.:可重復使用柔性電子系統用于醫療健康監測 2025-06-26
- 武漢大學陳朝吉、高恩來/林科院林化所劉鶴 AFM:二氧化碳衍生多功能生物基非異氰酸酯聚氨酯助力紙張轉化為紙塑 2025-06-30
- 廣西大學趙輝課題組 CEJ 綜述:高強度自修復高分子材料的研究進展 - 機械強度與修復效率的平衡 2025-06-12
- 西南林大杜官本院士、楊龍研究員團隊 CEJ:兼具高強度、優異阻燃性和尺寸穩定的多功能竹基復合材料 2025-05-20
- 蘇大李剛、附一院李峰和附四院沈罡 IJBM: 兼具抗菌和抗狹窄功能的載藥可降解輸尿管支架 2025-06-29
