順鉑及其衍生物已被廣泛用于治療癌癥,但是它們的臨床療效依然受到全身毒性和耐藥性的限制。這些局限性促使人們設計合成非鉑類抗癌金屬配合物,以試圖緩解順鉑類配合物帶來的全身毒性和抗藥性。其中,具有d8電子組態(tài)的銠(I)配合物與鉑(II)配合物是等電子體,且同為平面方形配位結(jié)構,是一類有競爭力的抗癌藥物。盡管已有一些具有抗癌活性的銠(I)配合物研究,但據(jù)所知,異腈基銠(I)配合物作為抗癌金屬藥物至今尚未有報道。該類銠(I)配合物在濃溶液中傾向于自聚集形成低聚物,并且基于Rh(I)···Rh(I)相互作用,可使其中某些銠(I)配合物展示出強的近紅外(NIR)磷光。這一特性督促研究人員發(fā)展基于異氰基銠(I)配合物的金屬類抗腫瘤藥物,并且通過近紅外磷光成像來原位監(jiān)測腫瘤的變化。

圖1. 含銠(I)的棒狀膠束EARh-1,EARh-2和EARh-3的靜電自組裝示意圖
前期,卜偉鋒教授課題組利用陽離子型鉑(II)配合物和陰離子嵌段共聚物之間的靜電超分子組裝,發(fā)展了以鉑(II)配合物離子微區(qū)為核,以中性高分子為殼層的聚合物納米膠束體系(Chem. Commun. 2011, 47, 9336; Langmuir 2015, 31, 2262; Soft Matter 2017, 13, 4791; J. Mater. Chem. C 2017, 5, 12500)。其中,源于Pt···Pt和π-π堆積相互作用的3MMLCT磷光發(fā)射顯著增強,纖維狀膠束具有顯著的電荷導電性。在這些工作的基礎上,他們進一步在水中制備了穩(wěn)定的,具有近紅外磷光的棒狀異氰基銠(I)配合物基的聚合物納米膠束(圖1),并將其應用于乳腺癌細胞系荷瘤裸鼠的活體近紅外磷光成像和抗腫瘤研究。

圖2. 在Rh-1(0.1 mmol·L-1)的溶液中滴加E136-b-A28的紫外可見吸收(a和b)光譜變化([-COO]-/[Rh(C≡N-2,6-xylyl)4]+ = 0,0.2,0.4,0.6,0.8,1.0,1.2,1.4,1.6,1.8,和2.0),(c)Rh-1、EARh-1、EARh-2和EARh-3(Rh-1的濃度為0.1 mmol·L?1)的水溶液圖片,(d)Rh-1、EARh-1、EARh-2和EARh-3的校正后的發(fā)射光譜。
含銠(I)配合物的聚合物納米膠束是由聚氧乙烯-聚丙烯酸鈉嵌段共聚物(En-b-Am)和[Rh(C≡N-2,6-xylyl)4]+(1/2SO4)-(Rh-1)在水中通過靜電作用形成的,利用紫外-可見吸收光譜可監(jiān)測這一自組裝過程(圖2)。在將濃的E136-b-A28水溶液滴加到稀的Rh-1水溶液的過程中,發(fā)現(xiàn)418和530 nm處單體和二聚體的吸收帶逐漸下降,而620 nm處的三聚體或三聚體以上的低聚物的吸收帶逐漸增強,并在[-COO]-/[Rh(C≡N-2,6-xylyl)4]+的化學計量比為1:1時達到飽和(EARh-1),在570 nm處出現(xiàn)吸收等吸收點。同樣,在E136-b-A42/Rh-1(EARh-2)和E136-b-A72/Rh-1(EARh-3)也觀察到類似的情況。因此,En-b-Am的加入可以增強Rh-1的水溶液中的Rh(I)···Rh(I)相互作用,使得單體和二聚體完全轉(zhuǎn)化成三聚體或三聚體以上的低聚物,對應的溶液顏色也從Rh-1的石藍色變成深天藍色(圖2)。同時,純的Rh-1水溶液的845和1033 nm兩處發(fā)射峰增強且藍移至812, 940和1013 nm,對應著620 nm處的Rh(I)···Rh(I)相互作用特征吸收帶的增強。這是典型的4dσ*→5pσ磷光激發(fā)態(tài)。值得注意的是,在相同的銠(I)配合物濃度和En(n = 136)嵌段聚合度的情況下,隨著Am嵌段聚合度增大,EARh-1、EARh-2和EARh-3的發(fā)光逐漸增強。類似的發(fā)光增強也出現(xiàn)在基于金(I)配合物的聚合物膠束體系中(Soft Matter 2018, 14, 31;Soft Matter 2018, 14, 3521)。
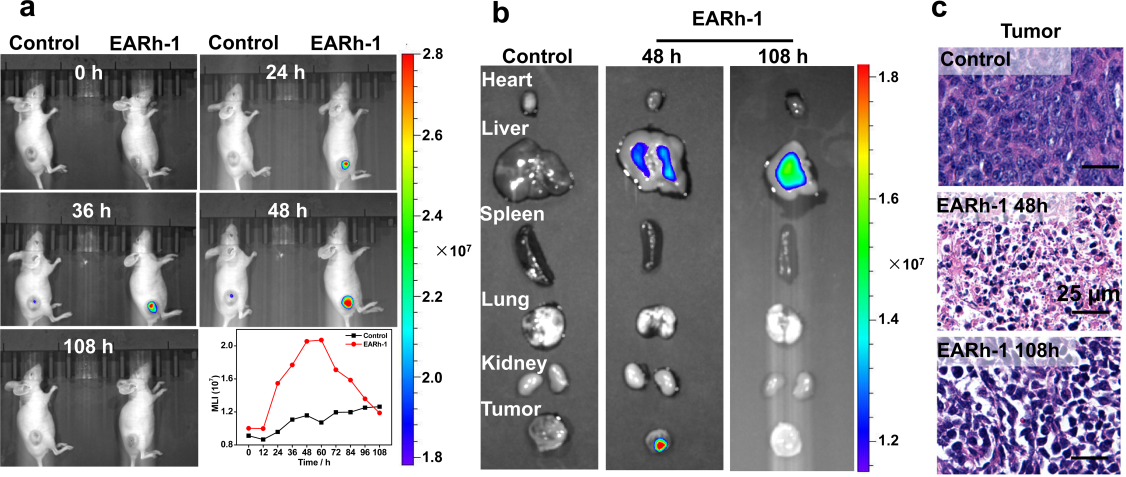
圖3. EARh-1經(jīng)小鼠尾靜脈注射的不同時間點的活體磷光成像的(a)平均發(fā)光強度、(b)切除的腫瘤及器官的磷光成像和(c)腫瘤組織的H&E切片染色圖
含銠(I)配合物的聚合物棒狀膠束具有良好的穩(wěn)定性和強的近紅外磷光,可用作近紅外磷光成像探針。EARh-1棒狀膠束的尺寸為95 nm,是活體內(nèi)血液循環(huán)的理想尺寸。其Zeta電勢為?5.89 mV,在腫瘤中的滯留時間很長。因此,EARh-1棒狀膠束不僅可以對腫瘤區(qū)域進行近紅外磷光成像,還精確殺死腫瘤細胞而不會明顯的損傷主要器官(圖3)。應該指出,由于其在肝臟自然代謝過程會引起輕微但可恢復的肝臟損傷。
這一研究為設計兼具有近紅外磷光成像和化療活性的金屬配合物抗癌藥物提供了新的思路。相關成果以“Rhodium(I) Complex-Based Polymeric Nanomicelles in Water Exhibiting Coexistent Near-Infrared Phosphorescence Imaging and Anticancer Activity in Vivo”為題,發(fā)表于J. Am. Chem. Soc.。該論文的第一作者是蘭州大學化學化工學院博士生王俊,共同第一作者為北京化工大學聶井君博士;通訊作者是蘭州大學卜偉鋒教授,共同通訊作者是北京化工大學俞丙然副教授。
- 東華大學沈明武/史向陽教授團隊 AM:細胞膜仿生的聚合物納米顆粒通過放大內(nèi)質(zhì)網(wǎng)應激和誘導線粒體功能障礙的化療增強腫瘤免疫治療 2022-09-22
- 天津大學張育淼教授團隊和合作者Small:雙高分子聚合物納米膠束用于腫瘤治療和近紅外二區(qū)深部組織成像 2021-12-08
- 中國科學技術大學尤業(yè)字教授系統(tǒng)評述:響應性陽離子聚合物及聚合物納米膠束基因載體 2017-12-06
- 天津大學/北京大學 Sci. Adv.:基于光子微球索引的高容量DNA數(shù)據(jù)存儲隨機訪問技術 2025-06-21
- 青科大李志波/劉紹峰教授團隊 ACS Catal.: 新型鉿金屬催化劑鏈穿梭聚合制備高熔點烯烴嵌段共聚物OBC 2025-05-11
- 暨南大學寧印教授 Angew:單晶顆粒內(nèi)部微觀結(jié)構的空間調(diào)控 2025-05-05
- 港中大(深圳)趙征 / 唐本忠團隊 ACS Nano :多功能AIE納米馬達突破腫瘤屏障 - 實現(xiàn)精準光診療 2025-05-29
