二甲雙胍(metformin)作為治療2型糖尿病的一線藥物,在抗衰老、降血脂、保護心腦血管免疫調節等方面均展示一定的效用。最近,浙江大學高分子系金橋副教授和中科院化學所高明遠研究員合作研究發現,二甲雙胍在抑制腫瘤基質促進胰腺癌靶向治療方面應用潛力巨大。
胰腺癌號稱“癌中之王”,是預后最差的實體腫瘤,5年生成率不到5%。因為被激活的胰腺星狀細胞會分泌大量的細胞外基質,使胰腺腫瘤成為細胞外間質最致密的實體瘤。因此,向胰腺癌腫瘤內部遞送藥物異常困難,使化療效果變得極差。針對這一問題,上述研究團隊創新地提出,聯合二甲雙胍實現靶向遞送胰腺癌化療藥物吉西他濱的新策略。
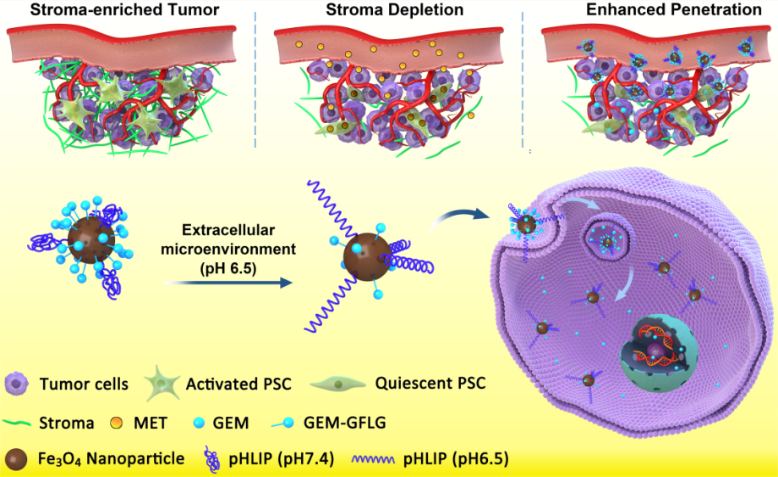
他們首先通過細胞研究發現,二甲雙胍可通過胰腺癌細胞的AMPK途徑,下調纖維化細胞因子TGF-β的表達,從而抑制胰腺星狀細胞的活性,使胰腺星狀細胞的基質相關蛋白α-SMA和膠原的表達量大大降低,進而有效抑制了腫瘤基質的生成。接下來的動物實驗進一步證實,二甲雙胍具有在體內下調腫瘤中的TGF-β、α-SMA和膠原表達,有效抑制腫瘤基質生成的能力,這非常有利于改善胰腺癌化療藥物的有效遞送。

利用上述發現,他們提出了通過二甲雙胍和吉西他濱先后給藥,以改善胰腺癌化療藥物吉西他濱的遞送效率的策略。同時,為了證實這一策略的有效性,他們圍繞吉西他濱設計合成了一個先進的可視化靶向藥物遞送系統。在這個系統中,他們采用磁性納米顆粒作為吉西他濱的載體,也利用其磁共振成像對比度增強功能,來可視化監控吉西他濱的有效遞送。同時,在顆粒表面耦聯了pH敏感插入肽(pHLIP),構建了一個智能化的藥物遞送系統(GEM-MNP-pHLIP)。當其在腫瘤組織中富集后,腫瘤組織的微酸環境會激活pH敏感插入肽pHLIP的腫瘤細胞靶向能力,實現GEM-MNP-pHLIP的腫瘤細胞靶向內吞,進而抑制胰腺癌細胞的增殖。
荷瘤鼠實驗結果表明,經二甲雙胍前期給藥后,吉西他濱納米藥物GEM-MNP-pHLIP在腫瘤中的滲透和滯留能力顯著增強,這可以通過磁性納米顆粒對腫瘤磁共振成像對比度的增強得到證實。而生物發光成像實驗則清晰地展示了,上述聯合用藥策略及先進的靶向藥物遞送對胰腺癌起到了顯著抑制作用。

該研究不僅為胰腺癌治療提供了全新的思路,也進一步拓寬了二甲雙胍的生物醫學應用,相關研究成果發表在J. Am. Chem. Soc. (2020, 142(10), 4944-4954)上,浙江大學高分子系金橋副教授和中科院化學所高明遠研究員為本文通訊作者。
論文鏈接:https://pubs.acs.org/doi/10.1021/jacs.0c00650
- 喻翠云/魏華團隊 ACS Nano:基于二甲雙胍的多功能納米平臺作為DNA損傷放大器 - 用于最大化放射免疫治療以克服放療耐藥 2025-04-14
- 天工大高輝/李曉暉團隊 Acta Biomater.:二甲雙胍多功能納米藥物克服具核梭桿菌介導的結直腸癌化療耐藥與免疫抑制 2025-02-11
- 四川大學高會樂教授課題組 AFM:二甲雙胍介導的空間特異性多響應無載體自組裝納米遞藥系統聯合化療重塑免疫抑制微環境 2024-02-21
- 東華大學李靜超 Angew:半導體聚合物納米反應器通過超聲觸發級聯乳酸消耗用于胰腺癌銅死亡-免疫治療 2024-05-07
- 唐本忠院士深大團隊王東教授、浙大計劍教授 Adv. Mater.:光觸發級聯療法 - NIR-II AIE分子聯合NO促進膠原降解,增強胰腺癌光診療 2024-01-04
- 法國艾克斯-馬賽大學彭玲教授團隊 AM: 利用模塊化自組裝樹狀分子納米探針通過核磁共振或核磁共振/近紅外熒光成像檢測胰腺癌 2023-12-13
