膠質瘤作為中樞神經系統極具侵襲性的腫瘤,因高侵襲性、遺傳異質性和血腦屏障(BBB)保護,傳統療法效果欠佳。聲動力療法(SDT)以其無創、深層組織穿透等優勢成為新興治療方式,通過超聲激活聲敏劑產生單線態氧破壞腫瘤細胞,同時利用聲空化效應增強藥物滲透。但小分子聲敏劑存在體內代謝快、選擇性差等問題,限制了療效。盡管納米載體系統整合聲敏劑有所改進,但能穿過BBB實現膠質瘤協同治療的載體設計仍具挑戰。
彈性蛋白樣多肽(ELPs)作為模擬天然彈性蛋白的人工多肽,憑借生物相容性好、免疫原性低、熱響應性及可被蛋白酶降解等優勢,在生物醫學領域備受關注。ELPs由VPGXG五肽單元構成,可通過序列定制實現對溫度、pH和光等刺激的響應,其自組裝行為使其能負載疏水藥物,延長藥物血液循環時間和提高藥物生物利用度。而多酚與金屬離子配位形成的金屬酚網絡(MPNs)在腫瘤化學動力學治療(CDT)和磁共振(MR)成像中展現潛力,特別是單寧酸/Mn2?(TM)MPNs,具有生物相容性、pH敏感性和CDT性能。其豐富的酚羥基使其可作為涂層材料吸附于納米材料上。此外,研究表明活性氧(ROS)除直接殺傷腫瘤細胞外,還可通過誘導免疫原性細胞死亡(ICD)和激活cGAS-STING通路觸發抗腫瘤免疫。Mn2?能增強cGAS對DNA的敏感性及cGAMP與STING的親和力,協同CDT/SDT有效激活抗腫瘤免疫反應。
基于此,東華大學史向陽教授團隊與法國波爾多大學Sébastien Lecommandoux教授課題組合作設計并構建了一種巨噬細胞膜仿生的金屬-多酚網絡包覆彈性蛋白樣多肽膠束用于實現原位腦膠質瘤的聲動力/化學動力/免疫治療(圖1)。研究團隊以分子量為33.7kDa、氨基酸序列為MW[VPGVG-VPGMG-(VPGVG)2]20的ELP通過共價鍵與聲敏劑二氫卟吩e6(Ce6)鏈接,并在水溶液中通過自組裝形成納米膠束,隨后包覆由單寧酸和Mn2+組成的MPN,從而獲得Ce6-ELP@TM。最后,Ce6-ELP@TM被巨噬細胞膜(MMs)偽裝獲得納米藥物Ce6-ELP@TM/MM。該納米藥物的物理化學特性、體外及體內的抗腫瘤效果、免疫激活效果及相關機制被詳細評價。
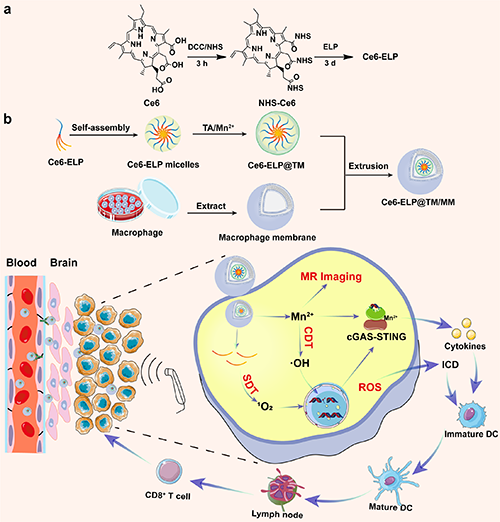
圖1. Ce6-ELP共聚物的合成(a)及Ce6-ELP@TM/MM的制備和用于原位腦膠質瘤治療示意圖(b)。
團隊首先通過1H NMR、熒光光譜、動態光散射、圓二色譜、TEM等證明了Ce6-ELP@TM/MM的成功制備,且具有良好的膠體穩定性及聲動力學特性,其平均尺寸約為58 nm(圖2)。
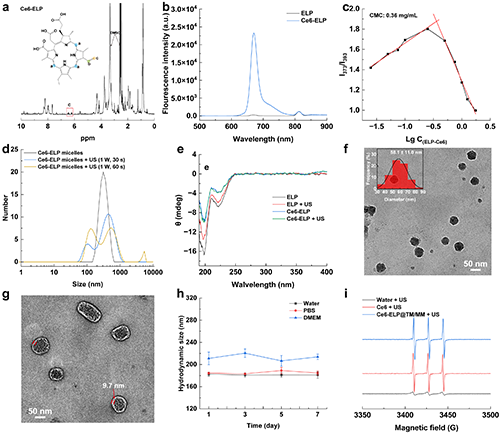
圖2.(a)Ce6-ELP在氘化DMSO中的1H NMR譜。(b)ELP和Ce6-ELP的熒光發射光譜(激發波長 = 405 nm)。(c)用芘作為熒光探針測定得到的Ce6-ELP納米膠束的CMC。(d)不同處理后Ce6-ELP納米膠束的水動力尺寸分布。(e)超聲輻照前后ELP或Ce6-ELP的圓二色譜。(f-g)Ce6-ELP@TM(插圖為Ce6-ELP@TM的尺寸分布直方圖)和Ce6-ELP@TM/MM的TEM圖像(比例尺為50 nm)。(h)Ce6-ELP@TM/MM分散在水中、PBS或含有10% FBS的DMEM中的水動力學尺寸(n = 3)。(i)在超聲輻照后的TEMP捕獲的1O2的ESR譜圖([Ce6] = 5 μg/mL, 1.0 MHz, 1.0 W/cm2, 30 s)。
隨后,團隊通過流式細胞術和激光共聚焦分析了腫瘤細胞對Ce6-ELP@TM/MM的攝取行為,并以CCK-8法初步評估了納米藥物的體外抗腫瘤效果(圖3),并以此結果確定了后續實驗中超聲施加的條件及藥物使用濃度。
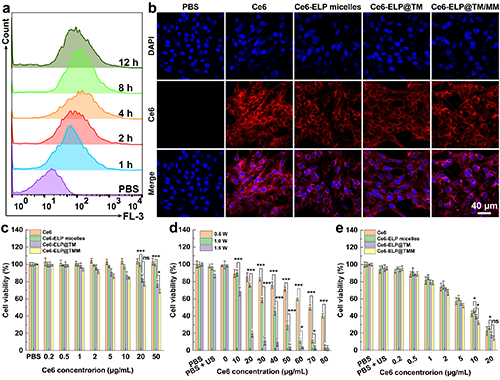
圖3. (a)C6細胞與Ce6-ELP@TM/MM培養不同時間后的流式細胞術檢測結果(n = 3)。C6細胞與不同材料孵育4小時后的激光共聚焦圖像(b,比例尺為40 μm)。(c)在沒有超聲的情況下,C6細胞與不同材料培養24小時后的活力(n = 6)。(d)在不同條件下,Ce6與C6細胞共培養后經不同條件超聲照射(1 MHz)的活力(n = 6)。(e)不同材料與C6細胞共培養后在超聲照射下的細胞活力(1 MHz、1 W/cm2和40 s,n = 6)。在圖c-e中,ns表示無統計學差異,*表示p < 0.05,***表示p < 0.001。
接下來,團隊深入研究了Ce6-ELP@TM/MM對C6細胞的詳細治療機制。通過細胞活死染色、細胞凋亡以及細胞內的ROS、線粒體膜電位等的檢測證實了,該納米藥物的化學動力學和聲動力學治療效果(圖4)。以蛋白質免疫印跡分析評估了癌細胞經納米藥物處理后,細胞內的STING通路的激活狀態,證明了Mn2+在細胞STING通路激活過程中的作用。
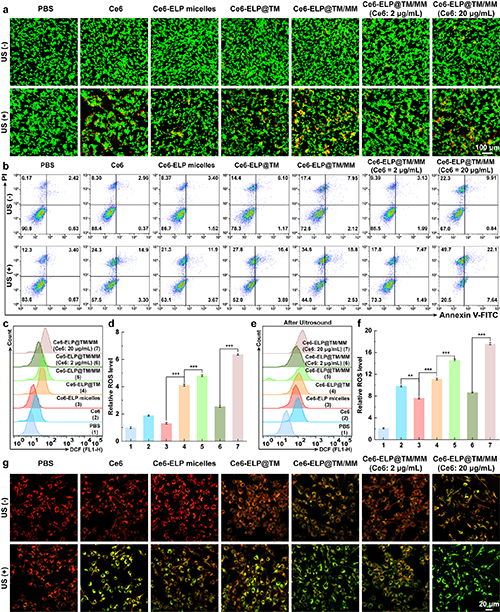
圖4.(a)不同材料處理C6細胞在超聲存在或不存在條件下的活、死染色結果(比例尺= 100 μm)。(b)經不同處理后的C6細胞的凋亡流式細胞術分析(n = 3)。(c-f)經不同處理的C6細胞內ROS水平變化的流式細胞檢測結果及定量分析(n = 3)。(g)經不同處理后的C6細胞內的線粒體膜電位變化檢測結果(比例尺= 20 μm,1 W/cm2, 30 s, 1 MHz)。在圖d和f中,**表示p < 0.01,***表示p < 0.001。
團隊進一步研究了納米藥物在超聲輻照下誘導免疫源性細胞死亡的效果。通過胞外ATP和HMGB-1研究及激光共聚焦顯微鏡觀察表明,超聲輻照下,納米藥物能夠導致ATP分泌及HMGB-1釋放增加(圖5b-c),同時能引起胞內大量的CRT外翻至細胞膜上(圖5d),從而說明其可在體外誘導癌細胞發生免疫原性死亡。隨后,Transwell實驗證明了引起的ICD能夠引起樹突細胞熟化(圖5e)。
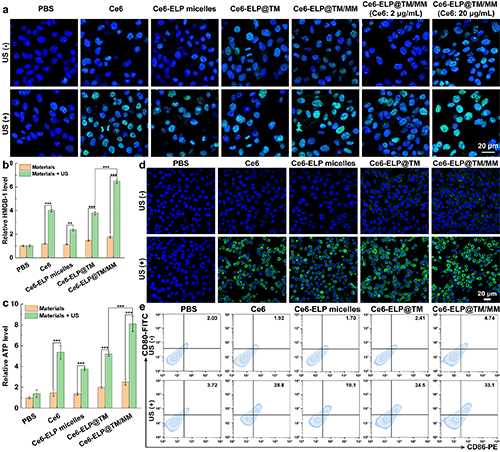
圖5.(a)經不同材料處理后C6細胞內γ-H2AX的免疫熒光染色結果。不同處理后C6細胞釋放ATP(b)、HMGB1的水平(c)和C6細胞膜表面暴露CRT的水平(d);不同處理的C6細胞與樹突細胞共孵育示意圖及樹突細胞熟化情況(e);在圖c-d中,**表示p < 0.01,***表示p < 0.001。
該納米藥物攜帶的Mn2+和Ce6分別具備MR成像和熒光成像的特性,通過對巨噬細胞膜仿生前后的納米藥物在腦部聚集情況的分析,驗證了Ce6-ELP@TM/MM能夠跨越血腦屏障實現高效的腦部遞送(圖6)。
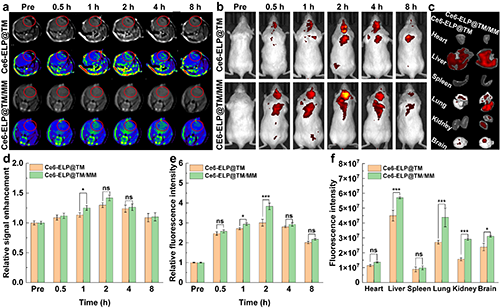
圖6.(a)尾靜脈注射Ce6-ELP@TM或Ce6-ELP@TM/MM前后不同時間點后的原位腦膠質瘤小鼠模型的T1加權MR圖像。(b)尾靜脈注射不同時間點后原位腦膠質瘤小鼠模型的體內和(c)離體器官熒光圖像。不同處理組荷瘤小鼠的膠質瘤MR信號強度定量分析(d)、熒光強度分析(e)和離體主要器官熒光強度分析(f)([Ce6] = 5 mg/kg,每只小鼠200 mL PBS,n = 3)。在圖d-f中,ns表示無統計學差異,*表示p < 0.05,***表示p < 0.001。
隨后,團隊通過建立C6原位腦膠質瘤模型,研究了Ce6-ELP@TM/MM的體內抗腫瘤治療效果。實驗結果表明,相同材料處理后,施加超聲明顯增強了治療效果,大大抑制了腫瘤的生長,這表明聲動力治療聯合化學動力學治療后比單一的化學動力學治療效果更佳(圖7)。通過免疫組化和免疫熒光切片進一步驗證了納米藥物的體內治療效果及其在體內對STING的激活情況。
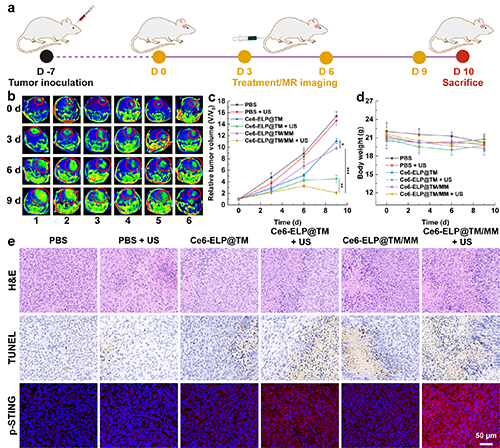
圖7.(a)Ce6-ELP@TM/MM納米復合物的荷瘤小鼠體內治療過程示意圖;(b)不同治療組的代表性MR圖像(1:PBS;2:PBS + US;3:Ce6-ELP@TM;4:Ce6-ELP@TM + US;5:Ce6-ELP@TM/MM;和6:Ce6-ELP@TM + US)以及不同處理后各組相對腫瘤體積(c)和小鼠體重(d)定量分析(c-d組,n = 5)。(e)腫瘤的免疫組織化學(H&E和TUNEL)和免疫熒光染色(p-STING)結果(標尺為50 μm)。在圖c中,*表示p < 0.05,**表示p < 0.01,***表示p < 0.001。
隨后,團隊研究了Ce6-ELP@TM/MM納米藥物介導的聯合治療后的體內免疫響應。結果表明,Ce6-ELP@TM/MM在施加超聲后,腫瘤和脾臟CD4+T細胞和CD8+T細胞的數量上調最為明顯,腫瘤部位的調節性T細胞(Tregs)顯著下調,證明通過聲動力/化學動力/免疫聯合治療后能夠有效刺激機體產生更多的殺傷和效應性T細胞,從而增強抗腫瘤治療效果(圖8)。
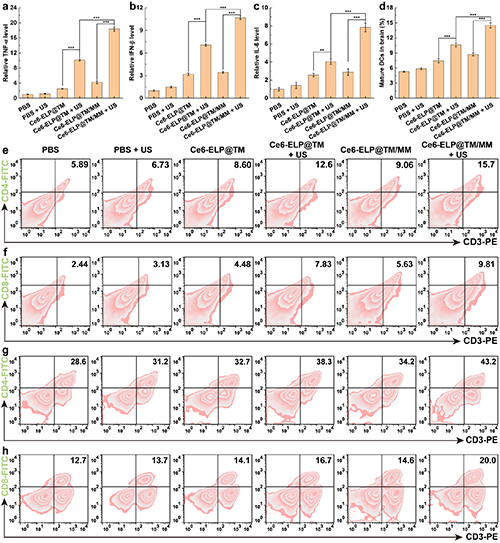
圖8. 不同處理后血清中TNF-α(a)、IFN-β(b)、IL-6(c)的相對水平(n = 3)。不同處理后腦內CD11c+CD80+DC的百分比(n = 3)(d)。(e)不同處理后腦內CD3+CD4+ T細胞和(f)CD3+CD8+ T細胞的流式細胞分析結果(n = 3)。(g)不同處理后脾臟CD3+CD4+ T細胞和(h)CD3+CD8+ T細胞的流式細胞分析結果(n = 3)(a-d組中,**表示p < 0.01,***表示p < 0.001)。
以上研究以“Biomimetic metal-phenolic network-coated elastin-like polypeptide micelles as an immunogenic cell death inducer for orthotopic glioma sonodynamic-chemodynamic-immune therapy”為題,發表于國際著名期刊Nano Today上。東華大學生物與醫學工程學院博士研究生王志強為第一作者,東華大學史向陽教授為通訊作者。該工作得到了國家自然科學基金委、上海市科委等項目的資助。
原文鏈接:https://doi.org/10.1016/j.nantod.2025.102810
- 煙臺大學陳大全教授團隊:結合中醫藥引經理論,構建基于桔梗多糖的巨噬細胞膜仿生納米載體用于靶向肺炎以及平息細胞因子風暴 2022-02-11
- 東華大學史向陽教授課題組《ACS Nano》:巨噬細胞膜仿生的多功能納米凝膠用于MR成像引導的原位腦膠質瘤聯合治療 2021-12-06
- 四川大學高會樂教授課題組Biomaterials:巨噬細胞膜包被的激光響應性納米遞藥系統用于腫瘤的免疫治療 2020-06-23
- 香港城市大學王彬課題組 CEJ:植物啟發梯度孔氣凝膠 - 實現界面蒸發中的快速水傳輸與低蒸發焓 2025-07-10
- 廈門大學曹學正教授 Macromolecules:高強高黏超流體動態高分子網絡的仿生設計及跨尺度流變理論模擬揭秘 2025-07-03
- 太原理工大學張虎林教授 Adv. Sci.: 熱電凝膠賦能仿生多模自監督指尖受體 2025-07-02
- 東南大學葛麗芹教授課題組 Small:在微氣泡上組裝金屬-多酚網絡一步制備功能性超薄微膠囊 2023-08-30
