癌癥納米疫苗具有訓練免疫系統以特異性識別和清除腫瘤細胞的能力。但是,疫苗的功效受到其無法高效進入引流淋巴結、被樹突狀細胞(DC)識別及攝取能力較差、及免疫原性較弱不足以引起DC的完全成熟等方面的限制。如何發展可實現高效靶向體內DC、促進其完全成熟的納米疫苗是目前研究的熱點。
自然界中,細菌等病原體含有多種病原體分子模式(PAMPs),可被表達有相應模式識別受體(PRRs)的DC等天然免疫細胞識別、吞噬,并引起細胞的活化和成熟。因此細菌及其衍生物可發展為有效的佐劑,以解決納米疫苗存在的上述問題。其中,細菌外膜囊泡(OMVs)在生物醫學領域受到廣泛關注。OMVs是主要由革蘭氏陰性菌分泌的外膜形成的球形囊泡,含有多種細菌來源的成分,包括酶、毒力因子、細菌特異性抗原和各種PAMPs,如脂多糖、脂蛋白、核酸、肽聚糖等。且因OMVs的不可復制性,可在很大程度上解決細菌帶來的體內毒性問題。
王育才教授課題組近期發表綜述文章,總結了OMVs在生物醫學領域的應用(J. Control. Release, 2020, 323, 253-268),詳細分析了OMVs的不同組分對其生物醫學應用的貢獻(圖1)。
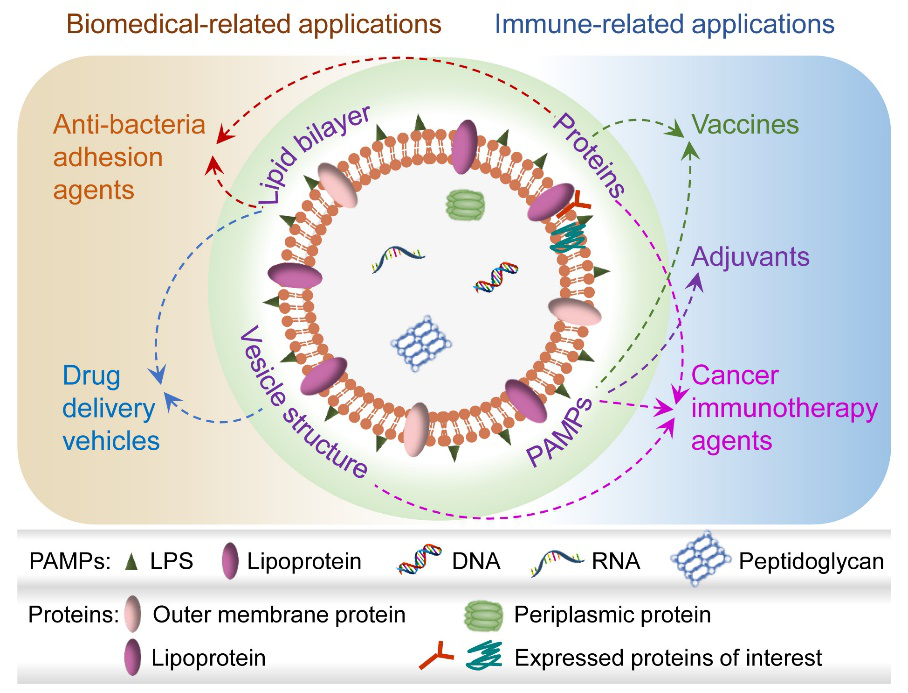
圖1、OMVs的組成及各組分對于生物醫學應用的貢獻。
該綜述還總結了OMVs的生物醫學應用(圖2)。由于OMVs包含細菌疫苗的兩種基本組分:細菌抗原和多種PAMPs,它已被發展為細菌疫苗,激活適應性免疫應答。類似地,PAMPs的存在使OMVs可作為強力的佐劑,用于增強和調節針對特定抗原的免疫應答。另外,OMVs的囊泡結構及其含有的PAMPs使其被發展成為藥物遞送載體以實現細胞靶向遞送或在特定臟器的富集。近來,基于OMVs含有細菌外膜來源的黏附分子,OMVs被用于模擬細菌外膜、結合到機體靶細胞,從而削弱真正細菌的粘附和感染。
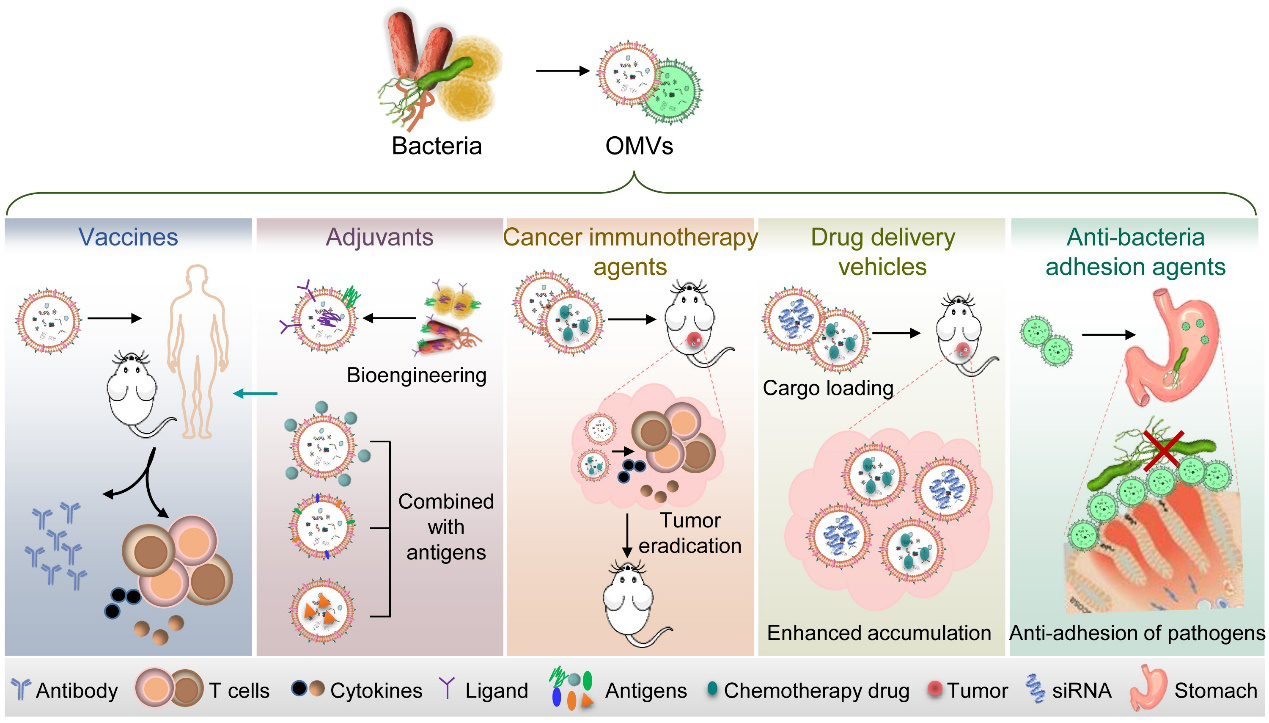
圖2、OMVs的生物醫學應用。
王育才教授課題組利用自然界中細菌等病原體可有效被中性粒細胞識別并吞噬的特性,發展出基于OMVs的仿生納米病原體(NPN)體系用于NPs的中性粒細胞靶向(Nat. Commun., 2020, 11, 1126)(圖3)。該策略可廣泛應用于多種類納米/微米顆粒的中性粒細胞特異靶向,且可應用于中性粒細胞參與的腫瘤/炎癥等多種類型疾病的治療。

圖3、(a)中性粒細胞可識別并吞噬多種病原體。(b)NPN制備過程。
近日,在此研究基礎上,王育才教授課題組發展了以高分子顆粒為內核的基于OMVs的腫瘤納米疫苗(BTs),實現了有效的DC靶向和成熟(圖4)。一方面,BTs中細菌衍生的病原體佐劑增強了DC靶向,成熟和抗原提呈。另一方面,BTs中的腫瘤細胞膜(TCMs)集合了多種多樣的腫瘤內源性抗原,通過放大腫瘤特異性抗原的加工和呈遞來創建多樣化的T細胞庫。佐劑和腫瘤抗原被組裝在亞穩定的細胞膜中,可避免在生物環境中的過早分離。由聚乳酸-乙醇酸(PLGA)組成的聚合物內核可支撐BTs結構,增強多價表位的展示并促進免疫識別。該疫苗的設計探索了OMVs和TCMs之間的協同作用,以實現由細菌向DC呈遞腫瘤抗原的相似功能,從而產生強大的抗腫瘤免疫反應。低至1 μg的OMVs即可顯著增強DC攝取和成熟、抗原提呈及抗原特異性T細胞應答。BTs的免疫可以產生出色的腫瘤預防效果,約30%的小鼠超過100天保持無瘤狀態。此外,BTs對已建立的實體瘤也顯示出優秀的治療效果,并可增敏免疫檢查點療法。

圖4、(A)TCMs不能有效被DC識別和攝取。(B)自然界中DC可有效識別、攝取細菌,對其抗原進行加工后提呈至T細胞。(C)BTs的制備。(D)BTs可被DC識別和攝取,引起DC的完全成熟和抗原提呈。
研究結果表明BTs可有效增強DC靶向和成熟(圖5A-D),且PLGA內核可進一步增強此效應(圖5E, F)。進一步我們發現,PLGA為內核的BTs(BTs@PLGA)可增強DC的抗原提呈,引發更強的T細胞應答(圖5G-I)。

圖5、(A, B)BTs增強DC攝取。(C, D)BTs引起更強的DC成熟。(E)不同內核的BTs形貌。(F)BTs@PLGA被DCs攝取最強。(G)BTs@PLGA引發更強的抗原提呈。(H, I)BTs@PLGA誘導更高比例的抗原特異性T細胞。
BTs@PLGA在以上方面的優越表現可轉化為卓越的抗腫瘤能力。在腫瘤預防實驗和腫瘤治療實驗中,BTs@PLGA均可有效抑制腫瘤的發生和發展,且可增強免疫檢查點抑制劑PD-1抗體(a-PD-1)的療效(圖6)。

圖6、(A-D)腫瘤預防實驗顯示BTs@PLGA有效抑制腫瘤發生。(E-G)腫瘤治療實驗顯示BTs@PLGA有效抑制腫瘤發展,且可增敏免疫檢查點抑制劑a-PD-1的治療效果。
該研究以Nanovaccines Integrating Endogenous Antigens and Pathogenic Adjuvants Elicit Potent Antitumor Immunity為題在Nano Today發表。王育才教授為該論文的通訊作者,李敏博士、博士生周漢和蔣為博士為該論文的共同第一作者。該研究工作得到了國家重點研發項目、國家自然科學基金、中央高校基本科研業務費專項基金和廣東省生物醫學工程重點實驗室開放項目的資助。
論文鏈接:https://www.sciencedirect.com/science/article/abs/pii/S1748013220301766
- 東華大學沈明武/史向陽團隊 Bioact. Mater.:基于納米凝膠的治療型納米疫苗通過全周期免疫調節實現腫瘤的預防及直接治療 2024-09-25
- 清華大學杜娟娟/軍事醫學研究院楊益隆合作團隊 ACS Nano:一種激活兩條天然免疫途徑的無佐劑納米疫苗 2024-03-19
- 上海交大劉盡堯團隊 Small:雙抗原展示納米疫苗 2023-12-08
- 中山大學吳丁財/黃榕康/鄭冰娜/王輝團隊 Adv. Mater.:具有長駐留性的可注射多孔炭納米酶水凝膠實現腫瘤的協同治療 2025-07-04
- 港中大(深圳)趙征 / 唐本忠團隊 ACS Nano :多功能AIE納米馬達突破腫瘤屏障 - 實現精準光診療 2025-05-29
- 山東大學欒玉霞教授團隊 Nat. Nanotech.:發現解決CAR-T細胞療法實體瘤療效受限的有效方法 2025-05-20
