納米藥物遞送系統(NDDSs)能夠通過被動靶向效應聚集于腫瘤部位,同時具有緩釋、靶向等諸多優點,是新型藥物遞送系統研究的熱點。但是腫瘤區域的異質結構和獨特的微環境形成了一系列生物屏障,例如高腫瘤間質流體壓力(IFP)和致密的腫瘤細胞外基質(ECM),在很大程度上阻止了NDDSs深入腫瘤組織。研究發現,可以通過調節NDDSs的粒徑、形狀以及表面性質等來改善其腫瘤穿透和細胞攝取效率。提高腫瘤治療效果的另一種方法是使用對具有腫瘤特異性刺激的NDDSs來控制藥物釋放,但是腫瘤微環境中常見內源性刺激水平含量比較低且分布不均勻,無法實現有效控制NDDSs的藥物釋放。所以改善NDDSs的低腫瘤穿透能力和不受控制的藥物釋放行為將極大提高其在臨床上的應用。
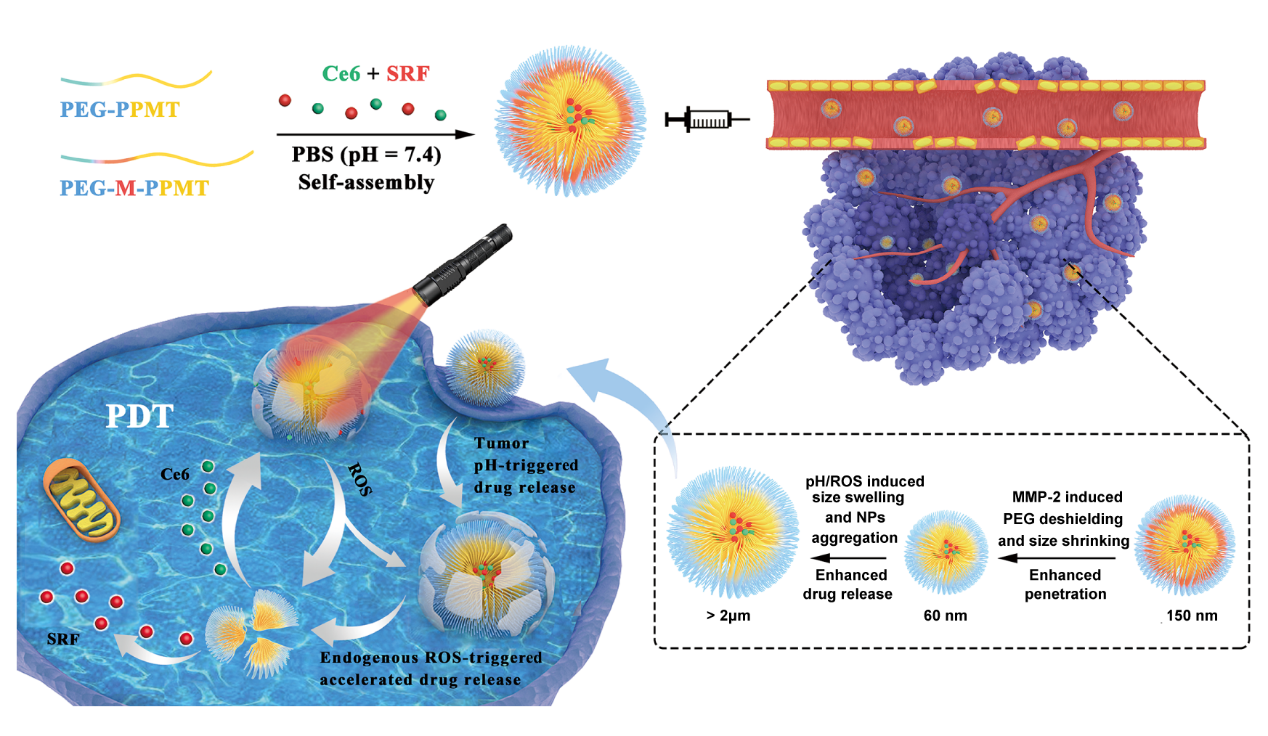
近年來,中山大學生物醫學工程學院劉杰副教授課題組構建了一系列基于功能性聚酯的腫瘤酸性以及氧化還原響應的納米藥物遞送載體(Materials Science & Engineering C, 2020, 111125, Journal of Materials Chemistry B, 2019,7, 651, ACS Applied Materials & Interfaces, 2017, 9: 30519)。在此基礎上,該團隊設計了一種新型的pH/ROS/MMP-2三重響應性PEG-M-PPMT納米顆粒同時包載抗癌藥物索拉非尼(SRF)和光敏劑(Ce6),實現了腫瘤部位高聚集、高穿透且具有級聯放大釋藥功能的化療/光動力學聯合治療。靜脈給藥后,PEG-M-PPMT納米粒子可通過EPR效應聚集在腫瘤部位;隨后腫瘤細胞外基質中過度表達的金屬基質蛋白酶(MMP-2)可使該納米粒子部分脫落PEG冠形成更小的顆粒并深入腫瘤組織;納米粒子被腫瘤細胞攝取后,胞內的酸性介質和高ROS水平會引起納米顆粒溶脹,加速藥物釋放,從而達到快速殺傷癌細胞的目的。更進一步,通過體外激光輻照光敏劑Ce6,可快速提高腫瘤細胞內活性氧濃度,進一步促進載體內藥物的級聯釋放,最終實現高效的多重響應型腫瘤化療和光動力一體化聯合治療。
該研究成果“Tumor microenvironment triple-responsive nanoparticles enable enhanced tumor penetration and synergetic chemo-photodynamic therapy”發表于生物材料權威期刊Biomaterials (DOI: 10.1016/j.biomaterials.2020.120574),中山大學生物醫學工程學院碩士生舒曼和唐俊杰為論文的共同一作,劉杰副教授和耶魯大學Zhaozhong Jiang研究員為本研究的共同通訊作者,中山大學生物醫學工程學院為第一單位和主要完成單位。
該研究工作得到國家自然科學基金(51773231)、廣東省自然科學基金(2016A030313315)和廣東省傳感技術與生物醫學儀器重點實驗室項目(2011A060901013)的資助。
原文鏈接:https://doi.org/10.1016/j.biomaterials.2020.120574
- 上海大學李文/張阿方教授團隊《Macromolecules》:動態共價鍵構筑多重響應手性溫敏樹枝化聚苯乙炔 2023-12-18
- 陜科大王學川/劉新華 Small:自適應多重響應熱致變色水凝膠用于節能智能窗和可穿戴溫度傳感 2023-09-03
- 中科院深圳先進院杜學敏團隊 AFM:仿含羞草的高靈敏、多重響應淀粉基智能驅動器 2023-07-11
- 山東大學崔基煒教授團隊 ACS Nano: 硬度可調的聚乙二醇納米顆粒調節納米-生物相互作用,增強靶向藥物遞送 2025-06-12
- 浙大周民教授團隊 Bioact. Mater.:微藻藥物遞送系統"降尿酸-抗炎-消化系統保護"三位一體協同用于痛風性關節炎的治療 2025-06-04
- 蘇大劉莊/楊光保教授團隊招聘博士后 - 材料合成、納米醫學(腫瘤診療、藥物遞送、免疫治療等) 2025-04-29
- 港中大(深圳)趙征 / 唐本忠團隊 ACS Nano :多功能AIE納米馬達突破腫瘤屏障 - 實現精準光診療 2025-05-29
