腦膠質(zhì)瘤(glioblastomas, GBM)是一種惡性神經(jīng)系統(tǒng)疾病,開(kāi)發(fā)診療新策略十分迫切。光熱治療及光聲成像因其時(shí)空可控及高成像分辨率等優(yōu)勢(shì),為腦腫瘤診療提供新思路。然而,用于腦膠質(zhì)瘤診療的光熱試劑受到腦部結(jié)構(gòu)特殊性的限制:1)光照時(shí)激光需穿透顱骨及腦組織,因此需要組織穿透性更深的吸收波段,相較于近紅外一區(qū)(NIR-I,600-900 nm),近紅外二區(qū)(NIR-II, 1000-1700 nm)的吸收波段可以實(shí)現(xiàn)更深的組織滲透性以及更小的組織光毒性;2)腦部存在血腦屏障(BBB)限制光熱劑(PTA)進(jìn)入腦實(shí)質(zhì)及腫瘤組織,降低了光熱試劑的效率及成像精確性。因此,開(kāi)發(fā)具有NIR-II吸收及BBB穿透性的光熱試劑十分重要。

圖1(a)N1小分子化學(xué)結(jié)構(gòu)及N1@2P NPs制備示意圖;(b)N1@2P NPs通過(guò)尺寸效應(yīng)和受體介導(dǎo)穿透血腦屏障,實(shí)現(xiàn)深層原位腦膠質(zhì)瘤光熱診療示意圖。

圖2(a)N1@2P NPs水溶液的NIR-II吸收光譜;(b)不同濃度的N1@2P NPs在1064 nm(1 W/cm2)激光照射下的光熱升溫效果;(c)不同濃度的N1@2P NPs的光聲信號(hào)圖片;N1@2P NPs和N1@F NPs對(duì)(d) bEnd.3和(e)U251細(xì)胞暗毒性測(cè)試及對(duì)(f)U251細(xì)胞光熱殺傷效果(1064 nm,0.8 W/cm2,5 min);(g)U251細(xì)胞死活染色分析。
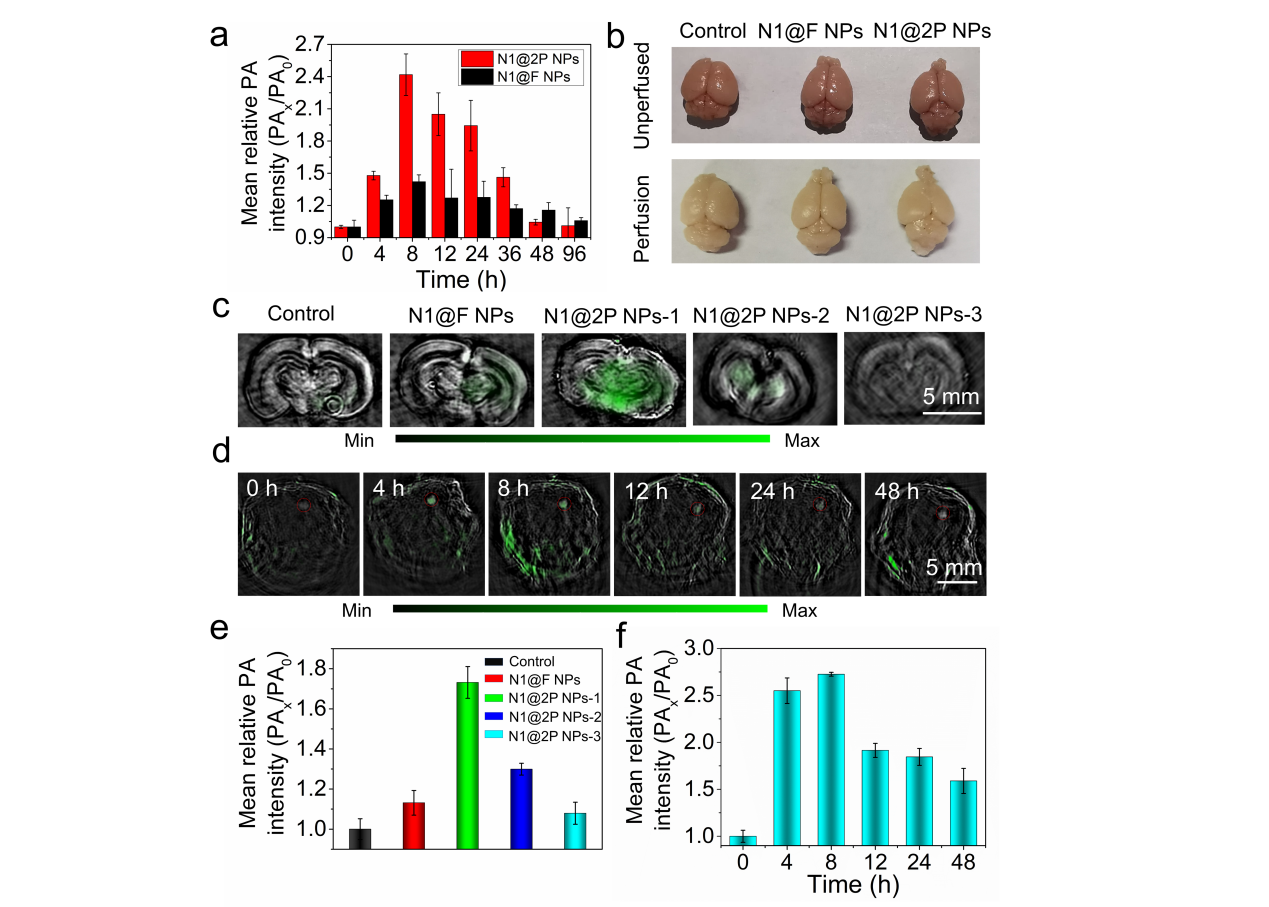
圖3(a)不同組別健康小鼠腦部光聲信號(hào)強(qiáng)度;(b)心臟灌注后小鼠腦部表觀圖片;(c, e)不同組別離體腦組織光聲信號(hào)及強(qiáng)度分析,N1@2P-1 ~26 nm, N1@2P-2 ~100 nm, N1@2P-3 ~200 nm;(d, f)小鼠原位腦腫瘤組織隨時(shí)間變化的光聲信號(hào)圖片和定量分析。
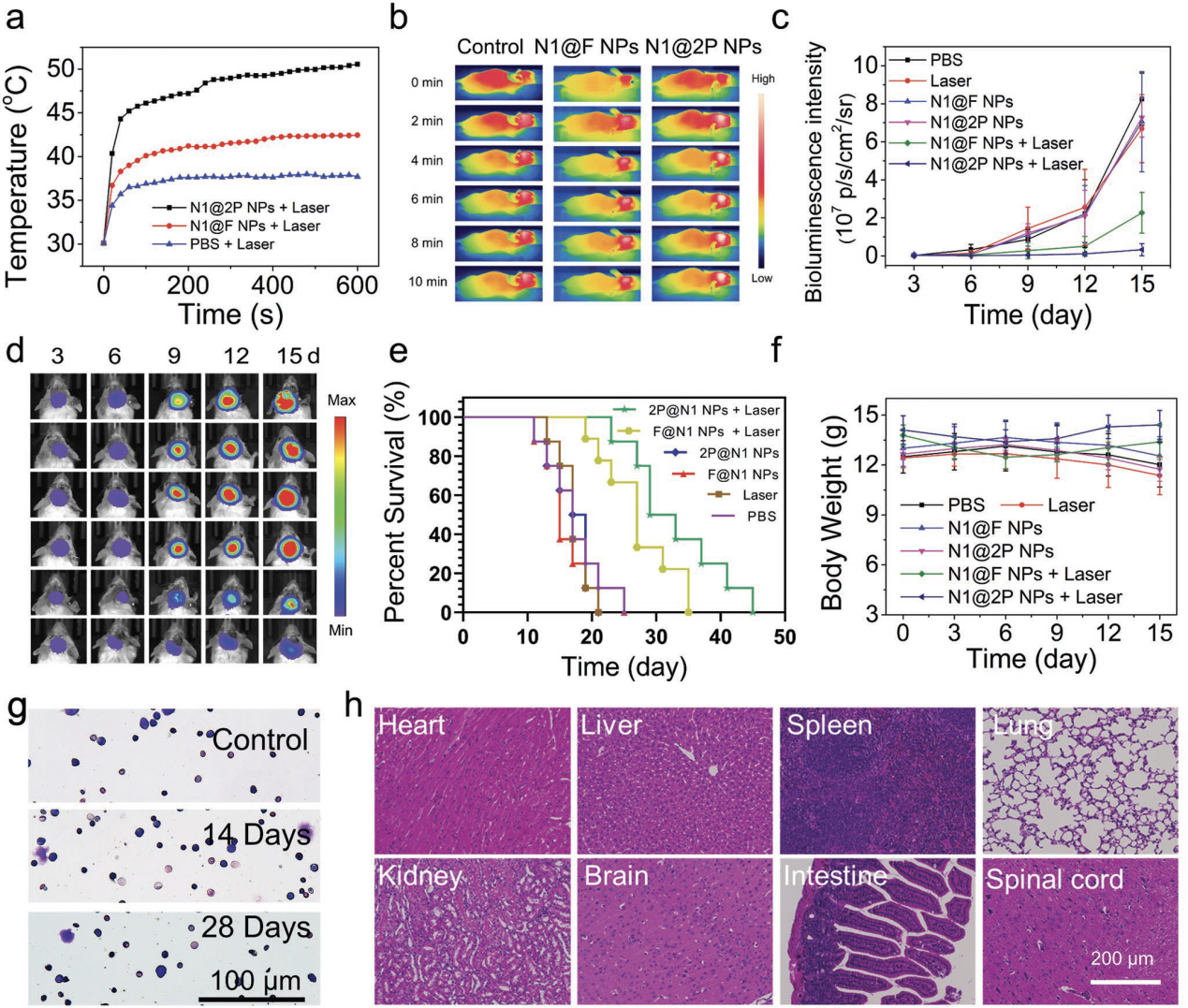
圖4 (a,b)原位腦腫瘤組織光照升溫曲線及紅外照片;(c,d)光熱治療后原位腦腫瘤組織自發(fā)熒光監(jiān)測(cè);(e)小鼠存活時(shí)間;(f)小鼠體重變化;(g)小鼠骨髓Wright染色;(h)H&E器官染色。
綜上,本研究通過(guò)引入D-A結(jié)構(gòu)和延長(zhǎng)π共軛體系的修飾策略,首次構(gòu)建了苝酰亞胺基NIR-II吸收光熱試劑。通過(guò)組裝調(diào)控納米粒子尺寸,并通過(guò)受體介導(dǎo)主動(dòng)的遞送策略,賦予N1高效的血腦屏障穿透性。將其應(yīng)用于深層原位腦腫瘤模型,實(shí)現(xiàn)高分辨率的近紅外二區(qū)光聲成像和顯著的光熱治療功效,為NIR-II光熱試劑的開(kāi)發(fā)提供理論依據(jù),并為改善腦腫瘤的診療現(xiàn)狀奠定基礎(chǔ)。
該論文通訊作者為北京化工大學(xué)尹梅貞教授、秦蒙教授,第一作者為管君博士。該研究工作得到國(guó)家自然科學(xué)基金(52130309,22201156,52003021)等資助。
原文鏈接:https://doi.org/10.1002/smll.202300203
- 桂工甄士杰/李美靜博士、廣醫(yī)張?zhí)旄桓苯淌凇⑷A工趙祖金教授、港中深唐本忠院士 AM:近紅外二區(qū)脂質(zhì)體多模態(tài)光診療新成果 2024-11-29
- 內(nèi)蒙古大學(xué)王建國(guó)教授、姜國(guó)玉教授、港科大于涵 ACS Nano:聚合物構(gòu)象扭曲策略改進(jìn)聚合物亮度用于近紅外二區(qū)癌癥光診療 2024-10-08
- 武漢科技大學(xué)王曉強(qiáng)《Nano Lett.》:基于硼簇的“離液效應(yīng)”構(gòu)建細(xì)菌響應(yīng)型水凝膠用于近紅外二區(qū)光熱治療 2024-04-09
- 中山大學(xué)吳丁財(cái)/黃榕康/鄭冰娜/王輝團(tuán)隊(duì) Adv. Mater.:具有長(zhǎng)駐留性的可注射多孔炭納米酶水凝膠實(shí)現(xiàn)腫瘤的協(xié)同治療 2025-07-04
- 港中大(深圳)趙征 / 唐本忠團(tuán)隊(duì) ACS Nano :多功能AIE納米馬達(dá)突破腫瘤屏障 - 實(shí)現(xiàn)精準(zhǔn)光診療 2025-05-29
- 山東大學(xué)欒玉霞教授團(tuán)隊(duì) Nat. Nanotech.:發(fā)現(xiàn)解決CAR-T細(xì)胞療法實(shí)體瘤療效受限的有效方法 2025-05-20
- 南開(kāi)大學(xué)齊跡、孔德領(lǐng)/醫(yī)學(xué)科學(xué)院工程所李穩(wěn) Nat. Commun.:長(zhǎng)波長(zhǎng)NIR-II光聲成像可視化血栓協(xié)同治療 2023-11-02
誠(chéng)邀關(guān)注高分子科技

- 北化徐福建/段順、北京口腔...
- 中山大學(xué)吳丁財(cái)/黃榕康/鄭冰...
- 中國(guó)農(nóng)業(yè)科學(xué)院麻類(lèi)研究所侯...
- 深大王奔等 Adv. Sci.: 磁場(chǎng)...
- 重醫(yī)大毛翔團(tuán)隊(duì)、哈工大賀良...
- 南理工/國(guó)科大杭高院王杰平...
- 廈門(mén)大學(xué)曹學(xué)正教授 Macromo...
- 山大周傳健教授、濟(jì)大趙松方...
- 華南農(nóng)大胡傳雙教授、林秀儀...
- 中國(guó)科大陳昶樂(lè)/安大陳敏、...
- 廈門(mén)大學(xué)侯旭教授團(tuán)隊(duì) AFM:...