受損的軟骨微環(huán)境通常會(huì)導(dǎo)致植入的干細(xì)胞存活率低和分化異常,從而形成機(jī)械性能較弱的纖維軟骨。合適且安全的仿生材料可為軟骨修復(fù)提供機(jī)械性能的同時(shí),促進(jìn)軟骨再生效果。然而,基于治療肽的仿生水凝膠的機(jī)械強(qiáng)度調(diào)控仍相對(duì)缺乏探索,而以負(fù)反饋方式進(jìn)一步應(yīng)用肽基仿生水凝膠進(jìn)行缺損軟骨修復(fù)至今也鮮有報(bào)道。近期,南華大學(xué)藥學(xué)院魏華/喻翠云教授團(tuán)隊(duì)報(bào)道了一種雙交聯(lián)肽基水凝膠以反饋調(diào)節(jié)方式促進(jìn)軟骨再生的研究。多種分子作用力(包括主客體相互作用和大量氫鍵)的整合賦予了水凝膠優(yōu)異的自愈性和機(jī)械強(qiáng)度,使其具有高度協(xié)同的潤滑性能和抗壓性能。更重要的是,獨(dú)特的整合肽VPM-pmTGF-β1可以實(shí)現(xiàn)pmTGF-β1的按需釋放,這種釋放是由MMP-3響應(yīng)性裂解VPM序列觸發(fā)的。將VPM-pmTGF-β1負(fù)載水凝膠系統(tǒng)植入SD大鼠模型的軟骨缺損部位后,MMP-3觸發(fā)的pmTGF-β1按需釋放以負(fù)反饋方式抑制了IκBα/NF-κB信號(hào)通路誘導(dǎo)的軟骨炎癥反應(yīng),同時(shí)促進(jìn)了BMSCs的定向軟骨分化,實(shí)現(xiàn)了高效的軟骨再生。
軟骨損傷后,M1巨噬細(xì)胞會(huì)釋放大量炎癥因子,如TGF-α、IL-1β和IL-6,從而破壞軟骨細(xì)胞的代謝平衡,引發(fā)炎癥反應(yīng)。這些炎癥因子與軟骨細(xì)胞膜上的特定受體結(jié)合,激活IκBα/NF-κB信號(hào)通路,導(dǎo)致軟骨細(xì)胞釋放大量誘導(dǎo)型一氧化氮合酶(iNOS)、環(huán)氧化酶-2(COX-2)和基質(zhì)金屬蛋白酶(MMPs)。在釋放的MMPs中,MMP-3在早期損傷軟骨中高表達(dá),通過直接分解軟骨細(xì)胞外基質(zhì)(ECM)成分和激活其他幾種促MMPs,在軟骨降解中發(fā)揮關(guān)鍵作用。因此,抑制早期巨噬細(xì)胞釋放的炎癥因子可能是防止受損軟骨基質(zhì)降解、減輕患者疼痛的有效策略。盡管干細(xì)胞療法通過軟骨分化和旁分泌機(jī)制顯示出軟骨再生的巨大潛力,但軟骨損傷微環(huán)境中普遍存在的炎癥和氧化應(yīng)激導(dǎo)致植入的干細(xì)胞存活率低或異常分化為機(jī)械性能極弱的纖維軟骨。因此,對(duì)受損的關(guān)節(jié)微環(huán)境進(jìn)行多維調(diào)節(jié)以促進(jìn)干細(xì)胞存活和增殖以及定向軟骨分化以促進(jìn)軟骨再生至關(guān)重要。

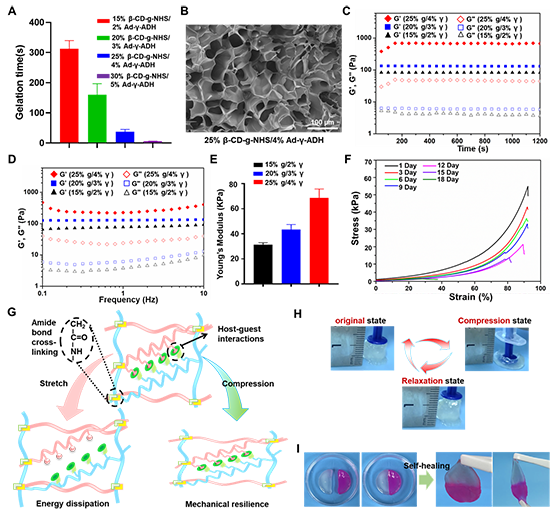

圖3. 功能性多肽水凝膠促進(jìn)軟骨再生。
原文鏈接:https://doi.org/10.1016/j.cej.2023.145228
- 西交大魏釗/北大楊根 Small 綜述: 力學(xué)性能可調(diào)動(dòng)態(tài)水凝膠用于3D類器官培養(yǎng) 2025-06-27
- 華科大吳豪等 Sci. Adv.:可重復(fù)使用柔性電子系統(tǒng)用于醫(yī)療健康監(jiān)測(cè) 2025-06-26
- 西華師范大學(xué)劉琦課題組 CEJ:無引發(fā)劑太陽能光聚合制備高性能、寬環(huán)境適應(yīng)性和可回收水凝膠傳感器 2025-06-26
- 浙江大學(xué)張鵬/王幽香 Adv. Sci.:具有交替序列的聚(谷氨酸-賴氨酸)EK肽水凝膠 - 可抵抗小鼠和靈長(zhǎng)類動(dòng)物的異物反應(yīng) 2024-02-27
- 蘭州大學(xué)王凱榮教授課題組 ACS Nano:一種由天然抗菌肽和ADP構(gòu)建的多功能水凝膠 2022-05-14
- 南方醫(yī)科大學(xué)邱小忠、蔡延濱《Compos. Part B-Eng.》:TEMPOL/聚吡咯復(fù)合導(dǎo)電多肽水凝膠用于心肌梗死修復(fù) 2022-03-24
- 華僑大學(xué)陳愛政和南方醫(yī)大王穎 Compos. Part B:基于dECM工程化微組織協(xié)同增強(qiáng)分化和抗炎作用促進(jìn)骨關(guān)節(jié)炎的軟骨再生 2024-12-13
