微針經皮給藥是一種非侵入性技術,通過穿透角質層,將微量藥物遞送至皮膚及循環系統。這種技術增強了藥物的吸收與生物利用度,降低了所需劑量,同時賦予微針持續釋放的特性,提供穩定的治療效果。然而,目前廣泛應用的可溶解型微針在藥物釋放后缺乏對深度和擴散范圍的精確控制,尤其在厚皮膚或深層組織中限制了其應用。研究者們正致力于實現藥物釋放的精確控制,探索如磁場和光基控制等外部方法,但這些方法常需復雜設備,增加了使用難度和成本。一些研究者還試圖通過靶向模塊改進藥物擴散方向,但這可能增加安全隱患并阻礙應用。近年來,氣體療法引起關注,通過氣體驅動藥物釋放,提供了一種創新的方法。然而,現有的氣體生成材料在反應條件和持續性上存在限制。
近期,天津醫科大學生物醫學工程與技術學院/天津大學醫學院鄭斌團隊開發了一種微生物驅動的氣動微針給藥系統,利用封裝的產氣微生物(如腸桿菌ATCC 13048)持續產生氫氣,提供藥物深層滲透的推進力。這種創新結合了微生物的產氣機制與經皮藥物釋放,能夠主動將藥物推送到更深層組織,有效克服皮膚阻力,從而實現藥物的深層擴散。在銀屑病的治療中,過度增殖的角質形成細胞是導致表皮增厚的主要原因。他們的微生物驅動微針技術通過在微針內封裝產氣微生物,持續產生氣體,從而推動藥物深入增厚的表皮,直接靶向過度增殖的細胞。這不僅抑制了異常增殖,還減少了炎癥,顯著改善了銀屑病癥狀。此技術為微針給藥提供了創新解決方案,實現了按需和可控的藥物遞送。
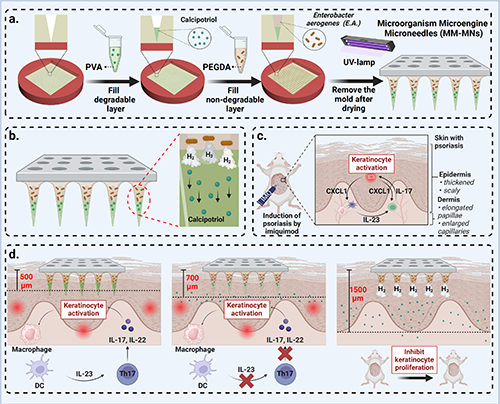
微生物作為氣動力源的潛力
腸桿菌(E.A.)作為一種常見的腸道微生物,能夠有效發酵多種糖類(如葡萄糖、乳糖和蔗糖)并持續產生氣體,主要生成氫氣(H?)。研究表明,E.A.的氣體生產與底物濃度、培養時間和接種量密切相關。通過氣相色譜分析,E.A.在適宜條件下(如20 mg/mL的葡萄糖濃度)可在12小時內產生高達28.7 mL的氣體,最大氣體生產速率達到1.65 mL/s。為了展示其作為微生物微發動機的潛力,實驗中通過瓊脂試管觀察到,E.A.可推動瓊脂達到最大位移12 mm,顯示出約0.04 N的推進力。這些結果為E.A.在動態氣體療法中的應用提供了基礎,表明其有潛力作為氣動力源。

圖2 微生物有潛力作為氣動力的來源
微生物微發動機微針的制備與驗證
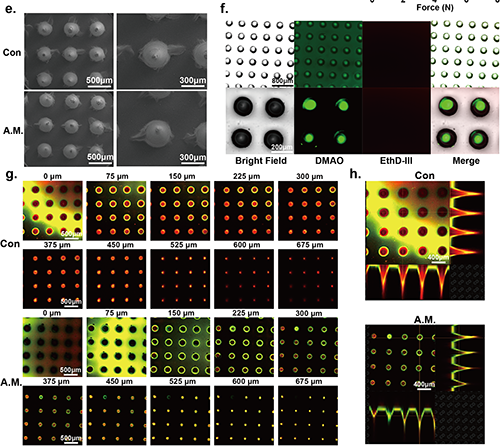
圖3 微生物微引擎微針(MM-MNs)的制備和細菌活性驗證
微生物微發動機微針(MM-MNs)氣體穿透深度與藥物釋放性能的表征
為了確保微生物微發動機微針(MM-MNs)的有效功能,必須定量評估其氣體生產能力及持續時間。研究表明,通過調整微針中加載的葡萄糖濃度,可以有效控制氣體的生成。實驗中制備了不同濃度的微針,結果顯示30 mg/mL葡萄糖的微針具備最長的氣體生產持續時間及最大氣體產量。此外,MM-MNs的氣體穿透能力通過插入豬皮進行測試,結果顯示在不同厚度的皮膚中,氣體滲透能力保持良好,特別是在5 mm厚度時仍能有效滲透。這為微針在推動藥物進入組織方面提供了重要基礎。綜合數據表明,E.A.所產生的氣體能夠滲透至真皮層,最大滲透深度超過5 mm,展示了其作為氣動馬達在藥物遞送中的巨大潛力。
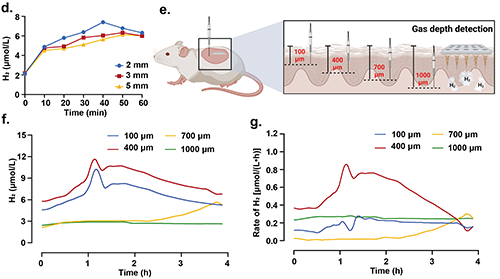
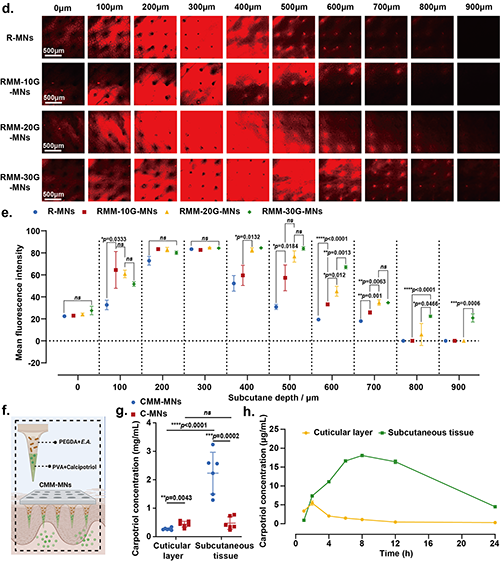
圖5 微生物微引擎微針(MM-MNs)藥物輸送性能的表征。
藥物在皮下的擴散受微生物發動機的氣體產生行為控制
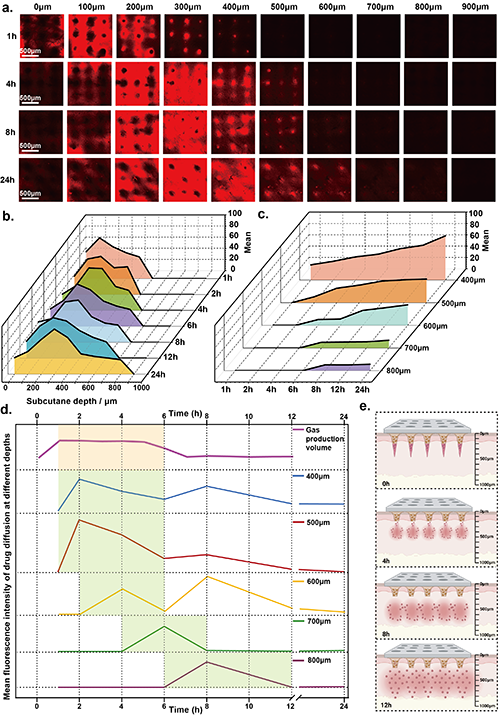
圖6 藥物在皮下的擴散受微生物引擎產生氣體行為的控制。
使用微生物微發動機微針(MM-MNs)治療牛皮癬

圖7 微生物微引擎微針(MM-MNs)對慢性銀屑病治療的療效。
總結
該研究提出了一種具有可調推進力的活體微針微引擎系統,利用內部加載的產氣微生物實現氣體動力學的驅動。這種系統顯著增強了微針在皮膚下的藥物溶解與釋放能力,提高了透皮給藥的深度和擴散效率。所開發的微針基質由PEGDA制成,包裹腸桿菌(E.A.),展現出超越傳統金屬基材的優越特性。微生物的持續氣體產生可施加超過0.04 N的推動力,使藥物深度可達1000 μm,較傳統微針提高200%以上的輸送效率。此外,微針中微生物的隔離設計有效防止了組織損傷,保證了生物相容性。在牛皮癬小鼠模型中,該系統通過輸送卡泊三醇顯著改善了癥狀,顯示出其在治療深層組織病變方面的潛力。氣體在皮膚微環境中的擴散和壓力分布是藥物輸送的關鍵因素。實驗發現,氣體在皮膚中的擴散表現出顯著的橫向和縱向特性,形成的局部高壓環境有助于藥物向深層擴散。通過調節微針中葡萄糖濃度,可以控制氣體的釋放速度和藥物的擴散范圍。未來研究應著重于微針孔中氣體擴散的物理模型及其對藥物輸送的影響,尤其是高分子量藥物的傳輸效率。此外,探索不同類型的微生物及其氣體成分的潛在療效,將進一步拓展該技術的應用范圍。通過設計環境響應的活微生物氣動微針,結合疾病特異性因素,進一步增強其藥物釋放的可控性和效率,從而提供一種創新的藥物輸送策略。
論文鏈接:https://www.nature.com/articles/s41467-024-53280-8
