光動力治療憑借其低毒性、低耐藥性和高時空選擇性等優點在腫瘤治療方面取得了顯著的效果。但其療效仍受腫瘤內部固有的乏氧微環境屬性、作用范圍小和光敏劑產ROS能力不足等因素制約,嚴重阻礙其在臨床實踐中的廣泛應用。近些年,具有生物活性的氣體(如H2、NO、CO)已被開發用于抗腫瘤治療,且由于CO具有較小的分子尺寸、高跨膜擴散率等優點,使其成為腫瘤治療的有利候選者。然而,單獨的傳統CO氣體治療效果并不明顯,且它在時空上的不可控性帶來嚴重的副作用。因此如何實現CO氣體在腫瘤部位精準的按需釋放以提高CO氣體對腫瘤的治療效果是亟待解決的關鍵科學問題。
基于此,華南理工大學唐本忠院士團隊馮光雪教授聯合南開大學丁丹教授合作構建了一種高效的多功能納米平臺(TPyNO2?FeCO NPs),該納米平臺主要通過利用兩親性的聚合物(DSPE-PEG2000)將高效的具有雙模態活性氧(ROS)產生能力的有機光敏劑和一氧化碳(CO)氣體供體十二羰基鐵(Fe3(CO)12)共封裝而得到。值得一提的是,在前期略構筑高效的I/II型有機光敏劑的研究工作基礎上(Biomaterials, 2022, 280, 121255; Mater. Chem. Front., 2023, 7, 96–105; ACS Nano, 2022, 16, 9130?9141; ACS Nano, 2023, 17, 16993?17003; Adv. Mater. 2023, 35, 2208692),本工作通過協同光誘導電子轉移機制(PET)策略,在陽離子化光敏劑(TPyOH)骨架中進一步引入4-硝基芐基,實現光敏劑 (TPyNO2)的分子內α-PET過程。這不僅抑制了光敏劑TPyNO2的輻射衰變,促使激發態能量重新定向到系間竄越以形成更多的三重態,而且有效促進了分子內的電子分離和轉移過程。使得TPyNO2在受光激發后,不僅有效提升單線態氧(1O2)生成,而且顯著增強其自由基型ROS生成效率。此外,在光照射下,TPyNO2?FeCO NPs通過I型和II型雙模態ROS協同介導實現CO氣體的高效受控釋放,克服了傳統CO釋放系統的局限性。最重要的是,TPyNO2?FeCO NPs在腫瘤細胞內表現出自加速的ROS?CO?ROS循環,有效提升細胞內的ROS水平。體外和體內實驗驗證了PDT和CO氣體聯合治療的良好抗腫瘤療效和生物相容性。該研究為高性能有機光敏劑的開發提供了新的見解,為光動力治療和CO氣體的協同可控治療提供新思路。
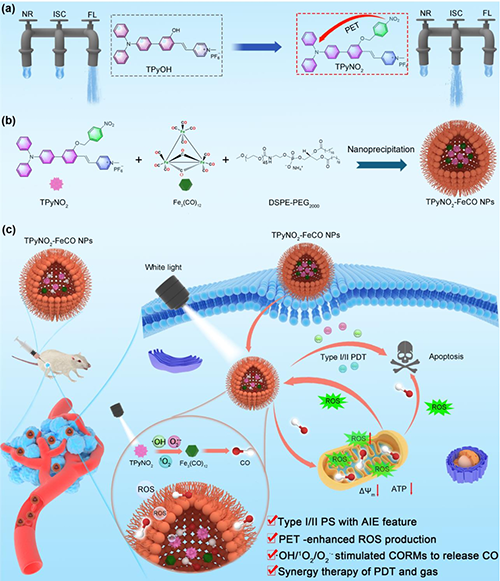
方案1. 用于協同PDT和CO氣體治療的TPyNO2?FeCO NPs納米平臺原理圖。(a)分子內光誘導電子轉移(PET)增強TPyNO2的ROS生成示意圖。NR:非輻射衰變;ISC:系統間交叉;FL:熒光。(b) TPyNO2?FeCO NPs的合成示意圖。(c)用于協同PDT和CO氣體治療的TPyNO2?FeCO NPs納米平臺示意圖。

圖1. (a) TPyOH和TPyNO2(50 μM)的紫外吸收光譜和(b) PL光譜。(c?f) TPyOH、TPyNO2、Ce6或CV在白光(20 mW cm?2)照射下(c) DCFH熒光增強、(d) DHR123熒光增強、(e) HPF熒光增強、(f) ABDA吸光度(399 nm)變化時程圖。(g) TPyOH和TPyNO2的HOMO和LUMO分布,由TD-DFT(B3LYP/6-31G(d,p))計算。(h) TPyNO2內α-PET過程示意圖。(i) TPyOH和TPyNO2的光電流響應。(j) TPyNO2的ROS生成過程示意圖。
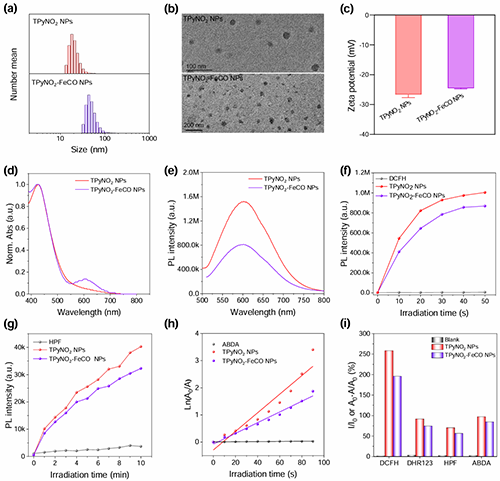
圖2. (a)水動力尺寸分布,(b)透射電子顯微鏡(TEM)圖像,(c) TPyNO2 NPs和TPyNO2?FeCO NPs的ζ電位。(d) TPyNO2 NPs和TPyNO2?FeCO NPs在超純水中的歸一化吸收光譜。(e) TPyNO2 NPs和TPyNO2?FeCO NPs在超純水(基于TPyNO2, 10 μM)中的PL光譜。激光照射TPyNO2 NPs和TPyNO2?FeCO NPs (基于TPyNO2,10 μM)時(f) DCFH熒光增強,(g) HPF熒光增強,(h) ABDA吸光度下降的時間圖。(i) TPyNO2 NPs和TPyNO2?FeCO NPs的ROS生成總述。
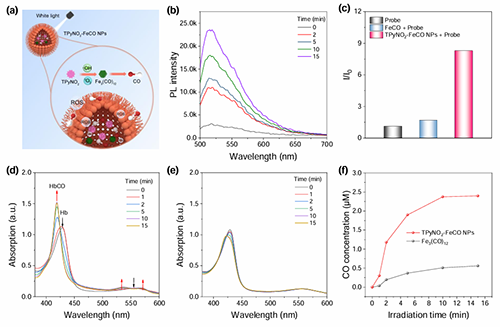
圖3. (a)雙模ROS刺激下TPyNO2?FeCO NPs釋放CO的示意圖。(b) TPyNO2?FeCO NPs存在下CO探針在白光(50 mW cm?2)照射下的PL光譜。(c)通過探針FL-CO-1熒光增強因子(I/I0)比較不同組間CO的釋放情況,其中I和I0分別為FL-CO-1光照前后的PL強度。(d)在TPyNO2?FeCO NPs存在下,Hb(4.2 μM)在白光照射下的吸收光譜變化。(e) Hb(4.2 μM)在Fe3(CO)12存在下的白光吸收光譜變化。(f)不同組別的有關一氧化碳釋放情況。

圖4. (a)可控白光照射TPyNO2?FeCO NPs和I/II型PDT和CO氣體協同燒蝕引發的特定ROS-CO-ROS回路示意圖。(b)與TPyNO2?FeCO NPs孵育不同時間的MB49細胞的CLSM圖像。(c)基于(b)圖像的半定量分析紅色熒光強度(FLI)。(d)使用CO熒光探針(FL-CO-1)檢測MB49細胞中的CO釋放。(e)基于(d)圖像的綠色熒光強度半定量分析。(f) DCFH-DA獲取的MB49細胞內ROS檢測。(g)根據(f)中的圖像對DCF綠色熒光強度進行半定量分析。(h)不同濃度的TPyNO2 NPs或TPyNO2?FeCO NPs孵育后MB49細胞的細胞活力,然后進行光照。(i)不同處理后的活細胞/死細胞染色,使用鈣黃素- AM(活細胞綠色發射)和碘化丙啶(死細胞紅色發射)測定。

圖5. (a)體內抗腫瘤實驗示意圖。(b)處理后小鼠平均體重變化。(c)不同處理后12天腫瘤體積生長曲線。(d)第12天小鼠腫瘤的代表性照片。(e)治療12天后小鼠腫瘤的重量。(f)不同處理后腫瘤組織H&E、TUNEL、Ki67染色分析。標尺= 100 μm。(G1)PBS, (G2) PBS + L, (G3) TPyNO2 NPs, (G4) TPyNO2?FeCO NPs, (G5) TPyNO2 NPs + L, (G6) TPyNO2?FeCO NPs + L。

圖6. (a)肝臟功能標記物,(b)腎功能標記物,(c)健康BALB/c小鼠經靜脈注射PBS(灰色)、TPyNO2 NPs(藍色)或TPyNO2?FeCO NPs(紅色)(1 mg/mL,100 μL /只小鼠)7天后的主要器官H&E染色切片的組織學分析。標尺:200 μm。
以上成果發表在ACS Nano期刊上。論文題目是“Dual-Mode Reactive Oxygen Species Stimulated Carbon Monoxide Release for Synergistic Photodynamic and Gas Tumor Therapy”。該研究得到了國家自然科學基金、廣東省自然科學基金、廣東省分子聚集體發光重點實驗室基金等項目的支持。馮光雪教授和丁丹教授為通訊作者,該工作還得到了唐本忠院士的指導。華南理工大學2020級博士生俞岳文(現為江西科技師范大學化學化工學院專任教師)、和華南理工大學2021級博士生張樂作為共同第一作者完成了該項研究。
論文鏈接:https://pubs.acs.org/doi/10.1021/acsnano.4c10277







