多肽組裝是一種構筑新型生物醫藥材料、解決多肽臨床應用難題的理想手段之一。傳統的多肽組裝材料通常需在體外制備后再遞送至病灶,這種制備-工作環境改變的模式影響材料穩定性和生物活性,同時難以確保藥物精準富集,造成相應的生物安全性隱患。近年來,研究人員提出原位組裝構筑多肽組裝材料的策略,即利用病灶生理環境下的特定刺激源,調控多肽非共價作用、誘導其在目標部位自發組裝,形成具有生物活性的納米結構。這種方法不僅提高了醫療精準性,還增強了藥物效果,為新型智能生物材料的開發提供了新的可能。盡管多肽原位組裝策略在生物醫學領域具有巨大潛力,但由于不同病生理條件下的組裝調控策略有限,相關研究仍面臨巨大挑戰。

圖1. 基于ncAAs調控的活細胞中多肽原位自組裝機制及應用示意圖。圖片來源Acc. Chem. Res.。
作者首先總結了自主研發的多種非典型氨基酸(表1),這些氨基酸可用于調節多肽組裝的刺激響應特性。隨后,作者介紹了由這些氨基酸構成的組裝基元在促進多肽有序組裝、解組裝及可逆組裝過程中的作用機制(圖2)。(1)促進多肽有序組裝的關鍵在于硫酸化酪氨酸和糖基化絲氨酸的刺激響應性切割,通過親水基團和大體積基團的解離提高分子間有序排列,加速組裝形成納米纖維。(2)解組裝過程則依賴于2-硝基咪唑丙氨酸的硝基向胺基的轉化,降低多肽序列疏水性,從而促進有序組裝的解離。(3)可逆組裝則是通過4-氨基脯氨酸和Se-甲硫氨酸的特性實現的:前者在酸堿環境下通過脯氨酸酰胺鍵的順-反構象異構化調控組裝,后者依賴硒醚與硒氧化物之間的氧化還原反應調節氨基酸疏水性與親水性轉變,從而實現可逆組裝。


接下來作者進一步總結了基于上述刺激響應性ncAAs反應所自主研發的活細胞內組裝體系。在活細胞中構建原位組裝系統,需要精確調控肽的非共價相互作用。由于多肽序列與其組裝行為密切相關,將刺激響應性氨基酸引入多肽骨架,能夠作為優化非共價相互作用的有效策略,從而實現對組裝過程的精準調控。基于此,作者利用4-氨基脯氨酸和Se-甲硫氨酸的高反應活性,建立了多種活細胞內自組裝體系,包括:自分類組裝(圖3)、自放大組裝及耗散組裝體系,實現了多肽活性增強,拓展了ncAAs在活細胞環境中的原位自組裝應用,還為癌癥及炎癥等重大疾病的精準治療提供了全新的策略。

圖3. 細胞內原位自分類組裝。圖片來源Acc. Chem. Res.。
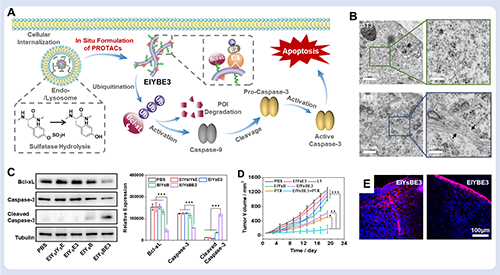
圖4. 超分子PROTAC示意圖。圖片來源Acc. Chem. Res.。
自從回國工作以來,余志林課題組致力于發展非天然氨基酸,用于調節病生理環境下的多肽組裝,并探索其在生物醫藥材料中的應用。這一研究不僅推動了氨基酸的創新設計,也加深了對復雜生理條件下原位組裝系統的基本原理和潛在機制的理解。然而,目前對原位形成的組裝體在體內的結構表征、生物降解動力學及降解途徑仍缺乏深入研究,而這些問題的解決將進一步推動自組裝多肽在生物醫學領域的廣泛應用。鑒于原位組裝在實時診斷和精準治療方面的獨特優勢,作者相信這類組裝體在未來醫療保健領域蘊含巨大潛力,并期待其進一步發展。
論文信息:
Noncanonical Amino Acids Dictate Peptide Assembly in Living Cells
Xin Liu, Binbin Hu, Zhilin Yu*.
Accounts of Chemical Research. DOI: 10.1021/acs.accounts.4c00796.
論文鏈接:https://pubs.acs.org/doi/10.1021/acs.accounts.4c00796
