傷口愈合乃是一個精細且繁雜的動態(tài)平衡進程,其中涵蓋免疫細胞的免疫調節(jié)、細胞因子的信號傳導以及細胞外基質的重塑等一系列精準且有序的協(xié)同活動。感染所引發(fā)的炎癥持續(xù)對周圍組織造成侵蝕,細菌大量繁衍進而破壞傷口微環(huán)境,加之長期使用抗生素所導致的耐藥性問題,上述這些因素相互交織,致使感染傷口的愈合面臨諸多困難。一氧化碳(CO)作為一種內(nèi)源性氣體信號分子,于生理調節(jié)領域發(fā)揮著極為關鍵的作用。其能夠對細菌的代謝進程形成干擾,進而抑制細菌的生長與繁殖;亦可對免疫細胞的活性予以調節(jié),以此減輕炎癥反應;并且,CO能夠推動細胞的增殖與分化,為組織修復工作提供有力支持。多聚脫氧核糖核苷酸(PDRN)是一種生物活性因子,能有效刺激生長因子分泌,加速血管生成,增強組織再生能力。把CO和PDRN用于傷口治療,通過局部給藥,這些活性物質可直接作用于傷口,顯著提高局部濃度,增強治療效果,還能降低對全身系統(tǒng)的不良影響。借助納米載體與水凝膠等前沿技術,可顯著提升其在體內(nèi)的穩(wěn)定性與生物利用度,以確保其更有效地發(fā)揮功效。因此,研發(fā)一種在近紅外(NIR)光觸發(fā)下能夠精準、高效釋放CO與PDRN的智能水凝膠敷料對于解決感染傷口愈合這一難題具有重大意義。
近期,青島大學胡浩、于冰聯(lián)合青島大學附屬醫(yī)院王開團隊在《Chemical Engineering Journal》期刊上發(fā)表了一篇題為A near-infrared responsive hydrogel loaded with Prussian blue-based nanocarriers for CO gas therapy of infected wounds的研究。

感染傷口由于持續(xù)感染和炎癥、局部微環(huán)境失衡以及抗生素耐藥性等原因,在愈合方面存在困難。PDRN是從深海魚精子中提取的一種核酸類藥物,具備促進細胞增殖、減少炎癥介質釋放、加速新生血管生成和增加膠原生成等功能,對于促進慢性傷口愈合效果積極。治療性氣體CO具有抑制細菌生長和繁殖、抗炎以及促進細胞增殖和分化的作用,但要實現(xiàn)其安全、有效和可控釋放面臨重大挑戰(zhàn)。研究團隊制備了一種能夠遞送釋放一氧化碳分子(CORMs)和活性因子PDRN的水凝膠(HPB-CO/PDRN@gel),用于感染傷口的高質量修復(圖1)。作者制備了含有醛基的氧化海藻酸鈉(OSA),并使其與改性的季銨化羧甲基殼聚糖(Q-CMC)通過縮合反應形成交聯(lián)網(wǎng)絡。用鹽酸蝕刻普魯士藍納米顆粒(PB NPs)制備空心PB納米顆粒(HPB NPs),利用相變材料(PCM)將羰基鐵(Fe3(CO)12)封裝在其空腔內(nèi)(稱為HPB-CO NPs)。當HPB-CO NPs到達病變部位時,PB NPs的光熱轉換特性會使PCM融化,從而引發(fā)CORMs的釋放。CO與細菌呼吸鏈結合,干擾其代謝過程,導致活性氧物種(ROS)積累,削弱細菌的DNA修復能力。同時,CO還能通過下調炎癥因子的表達和調節(jié)巨噬細胞表型發(fā)揮抗炎作用。釋放的PDRN可以刺激生長因子的分泌,促進組織再生,減輕傷口的炎癥反應,為傷口愈合創(chuàng)造有利的微環(huán)境。此外,PB NPs誘導的光熱療法(PTT)和帶正電的Q-CMC具有協(xié)同抗菌作用。這種多功能水凝膠為感染傷口的治療提供了一種有前景的策略。
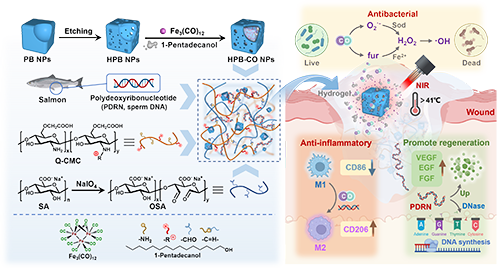
圖1. 納米粒子(HPB-CO NPs)和納米復合水凝膠(HPB-CO/PDRN@gel)的合成用于感染傷口治療。
在光熱性能和控釋行為測試中,通過調節(jié)NIR光的強度和照射時間,可以精確調控水凝膠的溫度和CO的釋放速率。水凝膠在NIR光照射下能夠迅速升溫,并在短時間內(nèi)達到穩(wěn)定的溫度;多次開關NIR光后,水凝膠仍能保持穩(wěn)定的光熱響應,這為其在實際應用中的精準治療提供了有力保障。通過實驗還證實了水凝膠能夠實現(xiàn)PDRN持續(xù)、緩慢的藥物釋放(圖2)。

圖2. 納米粒子和納米復合水凝膠的光熱行為和控制釋放能力。
因局部免疫紊亂、代謝異常以及組織修復信號通路受阻,感染傷口難以正常愈合。研究作者選取L929細胞和NIH 3T3細胞為模型進行實驗,證實了水凝膠具有良好的相容性,細胞存活率高。針對大腸桿菌和金黃色葡萄球菌的測試發(fā)現(xiàn),在NIR光觸發(fā)下,HPB-CO/PDRN@gel(L+)組的抑菌率超過99%,展現(xiàn)出卓越的抗菌性能(圖3)。

圖3. HPB-CO/PDRN@gel的生物相容性和抗菌活性評估。
作者制備的納米復合水凝膠能夠顯著促進細胞遷移和增殖,增加VEGF和α-SMA的表達,同時降低TGF-β的表達,有效加速傷口愈合過程。在免疫調節(jié)方面,該水凝膠可促使巨噬細胞從促炎的M1表型向抗炎的M2表型轉化,發(fā)揮強大的抗炎功效(圖4)。

圖4. 納米復合水凝膠在體外促進傷口愈合的機制及作用。
為了評估HPB-CO/PDRN@gel在體內(nèi)的治療效果,作者建立了金黃色葡萄球菌感染的小鼠全層皮膚損傷模型。研究發(fā)現(xiàn),HPB-CO/PDRN@gel(L+)組的傷口愈合速度明顯快于其他組,該水凝膠在NIR照射的輔助下能夠促進傷口處肉芽組織的形成和成熟,增加膠原蛋白的沉積,促進新血管生成,有效控制炎癥反應,加速傷口修復(圖5)。

圖5. 納米復合水凝膠對細菌感染小鼠傷口愈合的促進作用。
為深入探索HPB-CO/PDRN@gel水凝膠加速傷口愈合的潛在機制,研究團隊收集了經(jīng)該水凝膠處理的傷口組織開展了基因轉錄組分析。PI3K-Akt信號通路作為細胞中至關重要的信號通路,在細胞生長、存活、代謝、增殖、分化、遷移和血管生成中起著至關重要的作用。MAPK信號通路通過調節(jié)細胞周期相關蛋白的表達和活性來促進細胞生長和增殖。作者認為HPB-CO/PDRN@gel(L+)可以通過激活PI3K-Akt和MAPK信號通路調節(jié)傷口愈合,從而促進傷口修復(圖6)。

圖6. 傷口部位基因轉錄分析結果。
該近紅外響應水凝膠在感染傷口治療方面展現(xiàn)出了巨大的潛力,為臨床治療提供了一種全新的、更有效的策略。其多機制協(xié)同作用的特點,不僅能夠有效抗菌、抗炎,還能促進組織再生,實現(xiàn)快速且高質量的傷口愈合。同時,該水凝膠良好的生物相容性也避免了潛在的副作用,為患者帶來了更好的治療體驗。
青島大學碩士生李瑤為該文的第一作者,青島大學胡浩副教授、于冰教授以及青島大學附屬醫(yī)院王開主任為該文的共同通訊作者。青島溯博生物技術有限公司為本研究提供了具有專利技術的季銨化羧甲基殼聚糖(Q-CMC)。本研究得到了國家自然科學基金、山東省自然科學基金、青島市市南區(qū)科技計劃項目、青島大學生物多糖纖維成形與生態(tài)紡織國家重點實驗室開放課題以及山東省高水平學科項目的支持。
論文鏈接:https://doi.org/10.1016/j.cej.2025.162544
- 澳門大學李奕雯課題組 Sci. Adv.:同心冰模板法制備具有仿生環(huán)向纖維結構的強韌水凝膠 2025-06-25
- 合工大秦海利、從懷萍/中科大俞書宏 Adv. Mater.: 在超強韌水凝膠材料領域取得重要突破 2025-06-24
- 四川大學冉蓉、崔為 Adv. Mater.:基于本體共聚實現(xiàn)無溶劑制備強韌物理水凝膠 2025-06-23
- 天津大學仰大勇團隊 Sci Adv:DNA納米材料可控組裝賦能腫瘤基因治療 2023-09-04
- 天津大學 Adv. Mater.:智能DNA納米系統(tǒng)強化mRNA轉染 2023-07-31
- 香港中文大學(深圳)唐本忠院士團隊 AFM:自上而下法制備AIE/柔性木基傷口敷料 - 助力耐藥菌感染傷口快速愈合 2025-02-13
- 中山大學賈昭君課題組 AHM: “裝甲”活體益生菌平臺 - 糖尿病感染傷口愈合的創(chuàng)新解決方案 2025-01-25
