近日,中國(guó)科學(xué)技術(shù)大學(xué)王育才/蔣為團(tuán)隊(duì)在《Nature Biomedical Engineering》在線發(fā)表題為《Enhanced nanoparticle delivery across vascular basement membranes of tumours using nitric oxide》的研究論文。本工作聚焦于納米顆粒在實(shí)體瘤跨血管轉(zhuǎn)運(yùn)過(guò)程中的關(guān)鍵障礙—腫瘤血管基底膜(Basement Membrane, BM)屏障,提出利用一氧化氮(NO)實(shí)現(xiàn)基底膜屏障可控降解與重塑,從而提升納米顆粒在腫瘤組織內(nèi)的遞送效率。

盡管納米藥物在抗腫瘤治療中展現(xiàn)出巨大潛力,臨床數(shù)據(jù)顯示,最終抵達(dá)腫瘤基質(zhì)及腫瘤細(xì)胞的藥物比例仍不足1%。腫瘤血管結(jié)構(gòu)異常復(fù)雜,長(zhǎng)期被認(rèn)為是限制藥物遞送效率的關(guān)鍵因素。傳統(tǒng)增強(qiáng)滲透與滯留(EPR)效應(yīng)理論提出,納米顆粒可通過(guò)異常通透的腫瘤血管內(nèi)皮滲透進(jìn)入腫瘤組織,并因淋巴回流障礙而滯留。然而,該理論未能充分解釋納米顆粒跨血管遞送效率低的現(xiàn)象。
在前期研究中,本團(tuán)隊(duì)發(fā)現(xiàn)腫瘤血管內(nèi)皮細(xì)胞外側(cè)存在連續(xù)、致密的基底膜結(jié)構(gòu),其血管覆蓋率高達(dá)92%,構(gòu)成腫瘤血管“第二重物理屏障”。這一結(jié)構(gòu)顯著阻礙納米顆粒進(jìn)一步滲透至腫瘤基質(zhì),導(dǎo)致其滯留于血管周圍形成“血池”現(xiàn)象,從而嚴(yán)重限制藥物遞送和治療效果(Wang, Y. et al Nature Nanotechnology, 2024, 19, 95–105)。要實(shí)現(xiàn)高效的納米藥物腫瘤遞送,關(guān)鍵在于突破這一血管基底膜屏障,但該過(guò)程面臨三大挑戰(zhàn):其一,基底膜位于內(nèi)皮外側(cè),位置隱匿,納米顆粒需先跨過(guò)內(nèi)皮細(xì)胞方可精準(zhǔn)定位;其二,基底膜呈高度交聯(lián)的網(wǎng)狀結(jié)構(gòu),機(jī)械強(qiáng)度高,對(duì)常規(guī)治療手段具有抵抗性;其三,若過(guò)度破壞基底膜,可能誘發(fā)腫瘤轉(zhuǎn)移風(fēng)險(xiǎn),因此亟需發(fā)展一種精準(zhǔn)、可控、可逆的降解策略。
在血管新生過(guò)程中,基底膜的降解與重塑是驅(qū)動(dòng)內(nèi)皮細(xì)胞遷移與新生血管形成的關(guān)鍵環(huán)節(jié),而一氧化氮(NO)正是調(diào)控該過(guò)程的重要信號(hào)分子。受此生理過(guò)程啟發(fā),本研究提出一種“時(shí)空可控”的酶促基底膜重塑策略,通過(guò)釋放NO,精準(zhǔn)控制金屬基質(zhì)蛋白酶(MMP)活性,在維持血管結(jié)構(gòu)完整性的同時(shí),實(shí)現(xiàn)基底膜屏障的高效突破。該策略將原本阻礙遞送的“血池”轉(zhuǎn)化為納米顆粒外滲的“前哨陣地”,實(shí)現(xiàn)“主動(dòng)遞送”。該策略包括兩步關(guān)鍵過(guò)程:第一,NO誘導(dǎo)血管內(nèi)皮細(xì)胞間連接破壞,暴露其外側(cè)基底膜,以促進(jìn)納米顆粒準(zhǔn)確定位基底膜并聚集形成“血池”;第二,NO進(jìn)一步激活血池周邊內(nèi)皮細(xì)胞內(nèi)的MMP,短暫且可逆地精準(zhǔn)降解基底膜,促進(jìn)納米顆粒實(shí)現(xiàn)“動(dòng)態(tài)噴發(fā)式”血管外滲,增強(qiáng)其在腫瘤組織內(nèi)的滲透。為實(shí)現(xiàn)NO腫瘤內(nèi)精準(zhǔn)可控釋放,研究人員構(gòu)建了近紅外激光觸發(fā)的NO納米發(fā)生器(NanoNO),實(shí)現(xiàn)NO的時(shí)空可控釋放。NanoNO與臨床納米藥物聯(lián)合應(yīng)用后,在動(dòng)物模型中顯著提高了多種納米藥物在腫瘤中的富集與治療效果。尤其重要的是,該策略通過(guò)激活內(nèi)源性MMP,避免了外源性酶引發(fā)的不可控降解與轉(zhuǎn)移風(fēng)險(xiǎn),增強(qiáng)了基底膜調(diào)控的安全性與可控性。
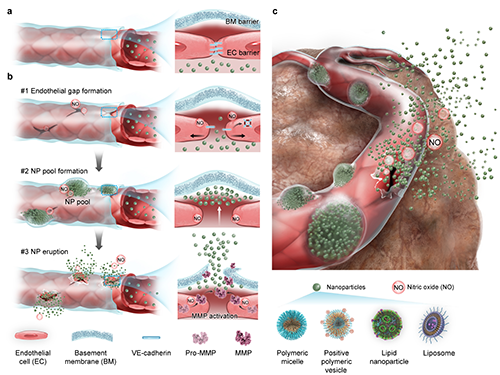
圖1、NO誘導(dǎo)基底膜屏障的空間催化降解,以增強(qiáng)納米顆粒進(jìn)入腫瘤。
透射與掃描電鏡觀察發(fā)現(xiàn),在小鼠4T1乳腺癌模型中,腫瘤血管基底膜呈多層致密、纖維狀片層結(jié)構(gòu)。進(jìn)一步對(duì)小鼠、兔及人類腫瘤樣本的系統(tǒng)性分析顯示,基底膜覆蓋率普遍超過(guò)95%,進(jìn)一步驗(yàn)證基底膜是限制納米顆粒進(jìn)入腫瘤基質(zhì)的關(guān)鍵屏障。為動(dòng)態(tài)追蹤納米顆粒的跨血管過(guò)程,研究團(tuán)隊(duì)建立了小鼠耳部4T1腫瘤活體成像模型,并使用熒光標(biāo)記的PEG-b-PLGA膠束作為模式納米顆粒。在靜脈注射納米顆粒1分鐘后,通過(guò)瘤內(nèi)注射NO供體,在腫瘤血管上觀察到納米顆粒“血池”形成,隨后出現(xiàn)“動(dòng)態(tài)噴發(fā)式”外滲,即大量納米顆粒進(jìn)入腫瘤基質(zhì),且滲透范圍與深度明顯提升。值得注意的是,這個(gè)噴發(fā)過(guò)程是動(dòng)態(tài)的,單個(gè)血池區(qū)域可在30分鐘內(nèi)發(fā)生多次噴發(fā),且噴發(fā)頻率與NO劑量呈正相關(guān)。該現(xiàn)象亦在胰腺癌、結(jié)腸癌等多種腫瘤模型中得到驗(yàn)證。NO可誘導(dǎo)多種類型的納米顆粒(如脂質(zhì)體、脂納米顆粒LNP及陽(yáng)離子聚合物)發(fā)生動(dòng)態(tài)噴發(fā)式的外滲現(xiàn)象,而對(duì)微米顆粒如葡聚糖作用較弱,表明其與顆粒尺寸密切相關(guān)。

圖2、NO誘導(dǎo)納米顆粒在血管處發(fā)生“動(dòng)態(tài)噴發(fā)式”外滲現(xiàn)象,促進(jìn)腫瘤基質(zhì)遞送。
接下來(lái),研究人員探究了NO突破基底膜屏障的機(jī)制。掃描電鏡顯示,NO誘導(dǎo)腫瘤血管內(nèi)皮細(xì)胞間形成大量?jī)?nèi)皮間隙(平均尺寸約195 nm)。體外HUVEC模型表明,NO顯著增大細(xì)胞間隙面積,減少細(xì)胞粘附連接。機(jī)制研究表明,NO通過(guò)誘導(dǎo)VE-cadherin酪氨酸658位點(diǎn)磷酸化,加速VE-cadherin降解,同時(shí)引發(fā)肌動(dòng)蛋白骨架重構(gòu),從而增強(qiáng)內(nèi)皮細(xì)胞間隙開放。在體內(nèi)實(shí)驗(yàn)中,NO同樣促使VE-cadherin表達(dá)下降及磷酸化水平上升,進(jìn)而打開內(nèi)皮屏障,暴露出原本被隱匿的基底膜結(jié)構(gòu)。

圖3、NO促進(jìn)內(nèi)皮間隙的打開,暴露隱藏在其外側(cè)的基底膜結(jié)構(gòu)。
使用Tie2-cre:Ai9轉(zhuǎn)基因小鼠進(jìn)行活體顯微成像,發(fā)現(xiàn)納米顆粒可通過(guò)NO誘導(dǎo)形成的內(nèi)皮間隙進(jìn)入內(nèi)皮下空間,并在基底膜與內(nèi)皮之間形成高熒光信號(hào)聚集的“血池”。延時(shí)成像顯示,血池在10分鐘內(nèi)形成并達(dá)到峰值,其密度高達(dá)每平方毫米血管面積2000個(gè),呈明顯NO劑量依賴性。這一現(xiàn)象在多種腫瘤模型均觀察到,表明NO可誘導(dǎo)內(nèi)皮細(xì)胞間隙打開,促進(jìn)納米顆粒精準(zhǔn)空間定位于基底膜區(qū)域。
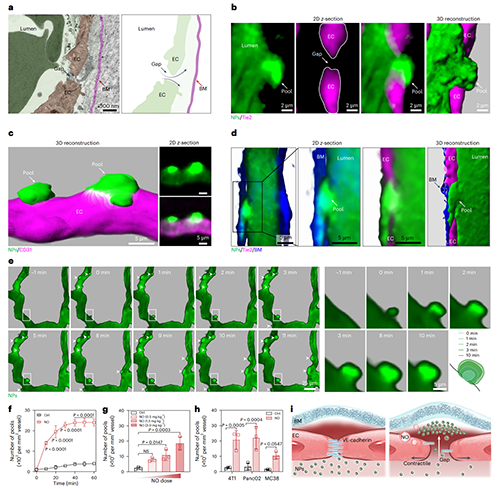
圖4、NO促進(jìn)納米顆粒形成血池,實(shí)現(xiàn)基底膜的精確空間定位。
在明確NO作用下納米顆粒定位在基底膜后,研究進(jìn)一步闡明其促進(jìn)納米顆粒跨越基底膜的分子機(jī)制。活體成像結(jié)果顯示,NO可誘導(dǎo)基底膜產(chǎn)生直徑約1–5?μm的動(dòng)態(tài)“孔洞”結(jié)構(gòu)。免疫組化、明膠酶譜分析及免疫熒光染色結(jié)果表明,NO可激活內(nèi)皮細(xì)胞內(nèi)的MMP,從而介導(dǎo)基底膜的降解過(guò)程。進(jìn)一步觀察發(fā)現(xiàn),活化的MMP的空間分布與納米顆粒的噴發(fā)式外滲現(xiàn)象高度時(shí)空共定位。結(jié)合分子機(jī)制研究與MMP抑制劑干預(yù)實(shí)驗(yàn)證實(shí),NO通過(guò)激活內(nèi)源性MMP,誘導(dǎo)基底膜發(fā)生瞬時(shí)可逆性降解,促使納米顆粒從血管腔向腫瘤間質(zhì)呈噴發(fā)式釋放,從而為高效腫瘤遞送提供了新的策略。
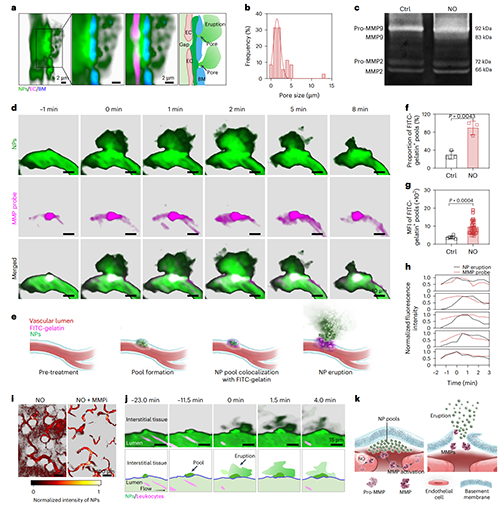
圖5、納米顆粒依賴于活化的MMP突破基底膜屏障并誘導(dǎo)血池噴發(fā)。
盡管NO具備良好的基底膜屏障調(diào)控能力,其在腫瘤靶向應(yīng)用中仍面臨釋放速率控制、系統(tǒng)副作用及組織特異性遞送等挑戰(zhàn)。作為概念驗(yàn)證,研究團(tuán)隊(duì)開發(fā)了NanoNO系統(tǒng),通過(guò)近紅外光觸發(fā)按需釋放NO,以提升遞送效率并增強(qiáng)靶向性。NanoNO以上轉(zhuǎn)換納米粒子(UCNP)為核心,外層修飾聚乙二醇并錨定N-亞硝胺類NO供體(NOD)。在980 nm激光照射下,UCNP發(fā)射的UV-Vis光激活NOD,實(shí)現(xiàn)NO的精準(zhǔn)釋放。
活體成像顯示,NanoNO在4T1腫瘤血管中誘導(dǎo)大量“血池”形成并隨著時(shí)間發(fā)生動(dòng)態(tài)噴發(fā),促進(jìn)納米顆粒向腫瘤深層滲透。該效應(yīng)歸因于近紅外光的組織穿透力及NO釋放的局部調(diào)控能力。進(jìn)一步研究顯示,MMP在此過(guò)程中發(fā)揮關(guān)鍵作用:NanoNO與MMP抑制劑聯(lián)用后,雖仍可形成血池,卻明顯抑制納米顆粒外滲。值得注意的是,NanoNO誘導(dǎo)的血管通透性增強(qiáng)具有良好可逆性,近紅外照射后血管屏障在24小時(shí)內(nèi)逐步恢復(fù),避免了永久性結(jié)構(gòu)破壞,從而在保障安全性的同時(shí),提供一個(gè)短暫但有效的“遞送窗口”。
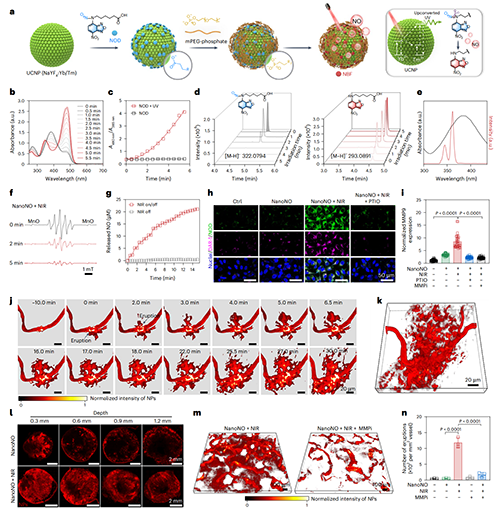
圖6、NanoNO實(shí)現(xiàn)可控釋放NO,突破腫瘤血管基底膜屏障,誘導(dǎo)納米顆粒“動(dòng)態(tài)噴發(fā)式”外滲行為。
體內(nèi)治療實(shí)驗(yàn)結(jié)果顯示,NanoNO聯(lián)合近紅外照射可顯著提升多種納米顆粒(包括聚合物納米顆粒、脂質(zhì)體、金納米顆粒)在原位及異位4T1腫瘤中的富集效率。該策略同樣顯著增強(qiáng)了臨床納米藥物的遞送效果,例如脂質(zhì)體阿霉素(Lipo DOX)與mRNA-LNP的遞送效率分別提升約3-4倍。其中,聯(lián)合NanoNO的Lipo DOX治療幾乎完全抑制腫瘤生長(zhǎng),抑瘤率達(dá)96%;聯(lián)合PTEN mRNA也可實(shí)現(xiàn)約80%的抑瘤效果。在兔VX2腫瘤模型中,NanoNO聯(lián)合DOX聚合物膠束治療的抑瘤率達(dá)94%,進(jìn)一步驗(yàn)證了該策略在不同動(dòng)物物種與納米平臺(tái)間的廣泛適用性。毒理學(xué)評(píng)估顯示,NanoNO具有良好的生物相容性,短期與長(zhǎng)期使用均未觀察到明顯毒副作用或促腫瘤轉(zhuǎn)移風(fēng)險(xiǎn)。
本研究在納米藥物領(lǐng)域取得了多方面的進(jìn)展。首先,本工作強(qiáng)調(diào)了非內(nèi)皮性屏障,尤其是基底膜在藥物遞送過(guò)程中的關(guān)鍵屏障作用。通過(guò)利用NO這一臨床可及的干預(yù)手段實(shí)現(xiàn)對(duì)基底膜結(jié)構(gòu)的可控調(diào)節(jié),顯著增強(qiáng)了多種已獲批納米藥物的治療效果,為納米藥物的臨床轉(zhuǎn)化提供了新契機(jī)。其次,研究系統(tǒng)揭示了NO與腫瘤血管間的相互作用機(jī)制,發(fā)現(xiàn)NO可誘導(dǎo)納米顆粒在血管內(nèi)形成動(dòng)態(tài)噴發(fā)式跨血管轉(zhuǎn)運(yùn)行為,從而實(shí)現(xiàn)高效腫瘤遞送。該策略具有良好的通用性,有望拓展應(yīng)用于蛋白質(zhì)藥物、抗體療法、疫苗及工程化細(xì)胞治療等多種治療體系。本研究構(gòu)建的遞送優(yōu)化體系不僅適用于腫瘤治療,也為多種存在基底膜屏障的疾病實(shí)現(xiàn)精準(zhǔn)遞送提供了具有廣泛適用性的通用平臺(tái)。
論文鏈接:https://www.nature.com/articles/s41551-025-01385-w
- 南京大學(xué)張曄課題組 Sci. China Mater.:高吸附電化學(xué)纖維傳感器用于實(shí)時(shí)、準(zhǔn)確檢測(cè)顱內(nèi)一氧化氮 2024-02-05
- 浙江大學(xué)計(jì)劍、王幽香團(tuán)隊(duì) ACS Nano:通過(guò)級(jí)聯(lián)觸發(fā)一氧化氮釋放和類芬頓反應(yīng)實(shí)現(xiàn)增強(qiáng)的經(jīng)皮化學(xué)動(dòng)力學(xué)療法 2023-08-27
- 華南師大周國(guó)富教授團(tuán)隊(duì)王耀教授課題組《ACS AMI》:無(wú)定形血晶素核/丙酮衍生碳化聚合物殼核殼納米球修飾石墨烯用于室溫NO傳感 2023-03-29
- 安中醫(yī)陳勝麒/胡容峰課題組《J. Control. Release》:新藤黃酸納米制劑實(shí)現(xiàn)肝癌的自增強(qiáng)抗血管治療 2023-05-09
- 南京大學(xué)甄敘、蔣錫群團(tuán)隊(duì)《Adv. Mater.》: 光控自富集的仿生半導(dǎo)體聚合物納米材料用于精準(zhǔn)腫瘤血管損傷治療 2023-03-23
- 中南大學(xué)劉又年教授課題組在腫瘤血管治療上取得新進(jìn)展:NIR-II響應(yīng)的水凝膠作為血管生成抑制藥物用于腫瘤微環(huán)境的重編程 2021-09-28
- 浙江大學(xué)姚克、韓海杰團(tuán)隊(duì) Sci. Adv.:基底膜仿生水凝膠促進(jìn)角膜損傷少瘢痕化愈合 2024-12-23
誠(chéng)邀關(guān)注高分子科技

- 杭師大黃又舉教授團(tuán)隊(duì) Angew...
- 西南大學(xué)甘霖/黃進(jìn)團(tuán)隊(duì) AFM:...
- 澳門大學(xué)李奕雯課題組 Sci. ...
- 華南農(nóng)大胡洋副教授/楊卓鴻...
- 武漢紡大徐衛(wèi)林教授、陳鳳翔...
- 昆士蘭大學(xué)喬瑞瑞團(tuán)隊(duì) Adv. ...
- 武漢大學(xué)劉抗教授團(tuán)隊(duì)《Adv....
- 西安交大盧同慶教授團(tuán)隊(duì)《Sc...
- 合工大秦海利、從懷萍/中科...
- 澳門大學(xué)周冰樸團(tuán)隊(duì) ACS Nan...
- 廣西大學(xué)林寶鳳教授團(tuán)隊(duì) CEJ...