納米酶因其高穩定性和可調的類酶活性,在腫瘤治療領域展現出巨大潛力。其中,鉑(Pt)基納米酶尤為突出,它不僅兼具過氧化物酶(POD)、過氧化氫酶(CAT)和超氧化物歧化酶(SOD)活性,可用于催化治療,還表現出優異的光熱轉換性能與出色的穩定性,已成為癌癥治療研究的熱點。然而,腫瘤微環境(TME)的弱酸性、缺氧、高谷胱甘肽(GSH)水平及低內源性H2O2等特征,嚴重制約了Pt基納米酶的催化效率及治療效果。同時,光熱治療(PTT)誘導的熱休克蛋白90(HSP90)過度表達,會增強細胞的耐熱性,進而削弱光熱療效。因此,通過設計優化Pt基納米酶的催化性能、調控腫瘤微環境以提升催化效率,并抑制熱休克蛋白表達以增強光熱治療(PTT)效果,有望成為腫瘤治療的一種有效策略。
基于此,東華大學史向陽教授/郭睿教授團隊構建了一種基于 CuPt 雙金屬納米酶與糖酵解抑制劑氯尼達明(Lon)協同作用的納米治療平臺(CPL@G5-BS),旨在通過調控 TME 實現增強的光熱治療(PTT)與催化治療(圖1)。研究團隊首先在部分乙酰化的第 5 代 PAMAM 樹狀大分子(G5)表面修飾碳酸酐酶 IX(CA IX)抑制劑——對羧基苯磺酰胺(BS),構建了載體 G5-BS。CA IX 作為一種在腫瘤細胞表面過度表達的膜蛋白,在腫瘤增殖和侵襲中起關鍵作用,是極具潛力的治療靶點。BS 修飾的載體 G5-BS 能夠被 CA IX 過表達的 4T1 腫瘤細胞高效攝取,并通過調控腫瘤細胞的pH“內降外升”來增強催化治療效果,同時抑制腫瘤轉移。隨后,通過在樹狀大分子 G5-BS 內部原位還原 K2PtCl4 和 CuCl2·2H2O 負載 CuPt 納米酶,并物理包封 Lon,最終制備得到納米平臺 CPL@G5-BS。構建 CuPt 雙金屬納米酶不僅可以顯著增強·OH 的生成并消耗 GSH,從而進一步提升化學動力療法(CDT)的療效,還能夠進一步提高納米顆粒的光熱轉換效率、增強光熱治療效果。與此同時,負載的 Lon 能夠通過抑制 HSP90 的表達顯著增強光熱治療效果,并通過減少腫瘤細胞的氧氣消耗,與納米酶的類過氧化氫酶(CAT)活性協同作用,共同緩解腫瘤乏氧。因此,CPL@G5-BS 納米平臺能夠通過調控 TME 實現增強的光熱/催化聯合治療,為開發新型癌癥治療策略提供了一個有前景的平臺。
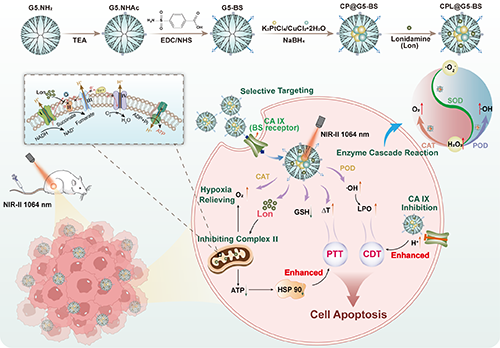
圖1. CPL@G5-BS用于腫瘤微環境調控光熱/催化療法的機制示意圖。
1H NMR和UV-vis證明了雜化納米平臺的成功合成(圖2a-b)。TEM結果顯示納米酶呈現均勻球形,平均粒徑為1.45 nm(圖2c-d)。XPS圖譜顯示Pt和Cu以多種價態共存(圖2e-f)。藥物釋放曲線顯示Lon在pH 5.5時釋放量更高,說明其具有pH響應性(圖2g)。最終材料的水合粒徑在7天內沒有明顯變化,證明其具有良好的膠體穩定性(圖2h)。此外,CPL@G5-BS具有良好的血液相容性,表明其具有安全生物醫學應用的潛力,能夠用于后續的體內實驗(圖2i)。
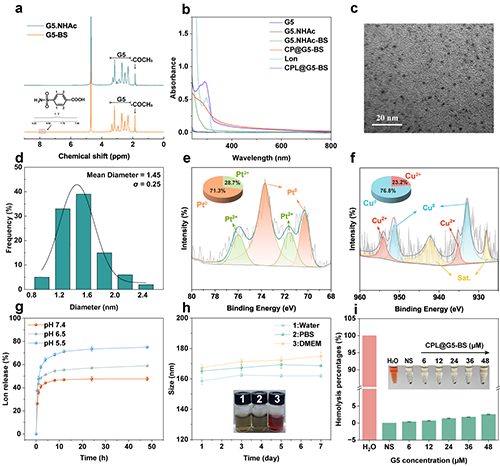
圖2.(a)G5.NHAc和G5.NHAc-BS的1H NMR譜圖。(b)G5、G5.NHAc、G5.NHAc-BS、CP@G5-BS、Lon及CPL@G5-BS的UV-Vis吸收光譜。(c)CPL@G5-BS的TEM圖像及(d)對應的尺寸分布直方圖。CPL@G5-BS的(e)Pt 4f和(f)Cu 2p高分辨率XPS譜圖。(g) 不同pH條件下Lon的釋放行為。(h) CPL@G5-BS分散于不同介質中7天后的水合粒徑變化。(i) 用Water、PBS及CPL@G5-BS([G5] = 6、12、24、36、48 μM)處理后的紅細胞溶血率和圖像。
團隊系統研究了CPL@G5-BS 的光熱性能及酶催化特性。光熱研究結果顯示在激光照射下,CPL@G5-BS溶液溫度與濃度呈正相關且具有高光熱穩定性(圖3a-b)。此外, Cu 摻雜可以增強其光熱性能(圖3c)。團隊進一步探究了Cu摻雜及光熱效應對CPL@G5-BS類酶活性的影響。CPL@G5-BS的類SOD酶活性超過PL@G5-BS,且在激光照射下進一步增強(圖3d)。TMB氧化反應證實了CPL@G5-BS的POD酶活性(圖3e)。在激光照射下,POD酶活性因溫度升高而增強(圖3f)。在弱酸性條件下其具有最強的POD酶活性(圖3g)。催化動力學結果進一步證明了其優異的類POD酶活性(圖3h-i)。除此之外,CPL@G5-BS還表現出優異的類CAT酶活性(圖3j-k)。總之,CPL@G5-BS在銅摻雜和激光照射下表現出優異的光熱性能、類SOD、POD和CAT酶活性。能夠在腫瘤部位持續產生ROS和O2,說明CPL@G5-BS在癌癥治療方面的巨大潛力(圖3l)。
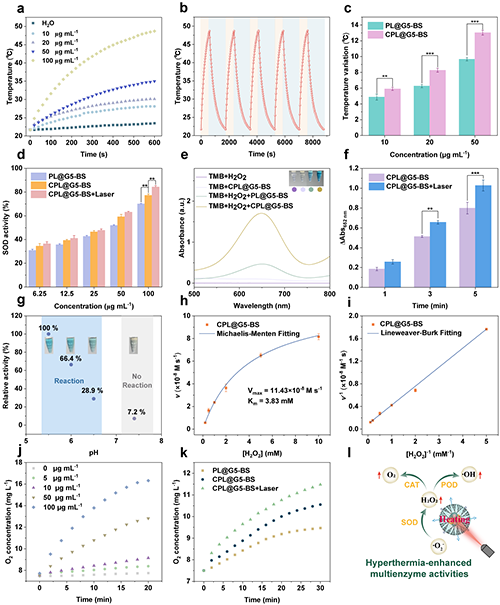
圖3.(a)不同濃度CPL@G5-BS溶液在1064 nm激光(0.6 W·cm-2)照射10分鐘下的溫度變化。(b)CPL@G5-BS溶液([Pt] = 100 μg·mL-1)在1064 nm激光(0.6 W·cm-2)下的循環加熱曲線。(c)PL@G5-BS與CPL@G5-BS在不同濃度下的溫度變化對比。(d)不同處理組的SOD酶活性。(e)pH 5.5條件下,不同溶液反應15分鐘后的吸光光譜及溶液顏色變化。(f)CPL@G5-BS在有無激光照射下652 nm處的紫外吸收強度對比。(g)pH對CPL@G5-BS類 POD酶活性的影響。(h)CPL@G5-BS的米氏動力學曲線及(i)Lineweaver-Burk雙倒數圖。(j)pH 6.5條件下,CPL@G5-BS與H2O2共存條件下的O2生成量。(k)不同處理組的類CAT酶活性([Pt] = 20 μg·mL-1)。(l)CPL@G5-BS光熱增強多酶活性的機制示意圖。
研究團隊選用4T1細胞進行體外實驗評價。細胞毒性實驗顯示CPL@G5-BS+Laser組對4T1細胞具有最佳的殺傷效果(圖4a-b)。細胞吞噬驗證BS介導的靶向作用促進了對材料的攝取(圖4c-f)。pH檢測結果顯示BS能夠有效抑制CA IX的活性,從而誘導細胞內pH降低、提升催化效率,并減少細胞外基質酸性、抑制腫瘤細胞轉移(圖4g-h)。
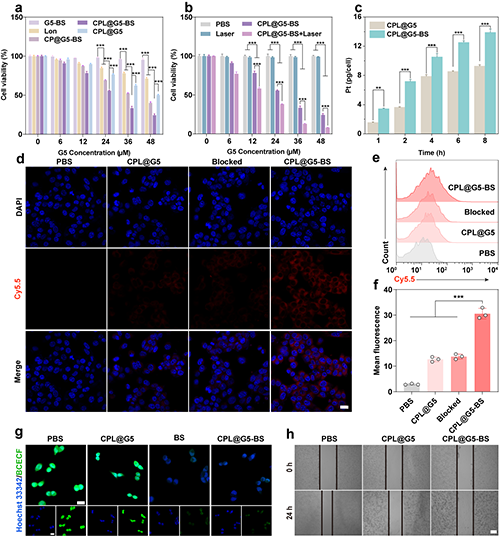
圖4.(a)不同材料對4T1細胞的細胞毒性評估。(b)不同處理對4T1細胞的細胞毒性評估。(c)4T1細胞與不同材料孵育后細胞內的Pt含量。(d)4T1細胞與PBS、GPL@G5、Blocked-CPL@G5-BS和CPL@G5-BS復合物孵育6小時后的CLSM圖像(GPL@G5和CPL@G5-BS用Cy5.5標記)。(e)流式細胞術檢測不同條件培養后4T1細胞中Cy5.5的滯留情況和(f)平均熒光強度。 (g) 不同處理4小時后BCECF染色的4T1細胞CLSM圖像。(h)不同處理條件下4T1細胞遷移的劃痕實驗圖像。在(d)和(g)中,標尺 = 20 μm。在(h)中, 標尺 = 500 nm。
隨后,研究團隊探究了CPL@G5-BS的體外抗腫瘤機制。CPL@G5-BS+Laser組誘導了最顯著的ROS產生、GSH耗竭和LPO積累(圖5a-d)。由于活性氧的積累會導致氧化應激和線粒體損傷的惡性循環,研究團隊采用JC-1評估了線粒體膜電位。CPL@G5-BS組幾乎沒有紅色熒光,表明催化治療和PTT的組合加劇了線粒體損傷(圖5e)。
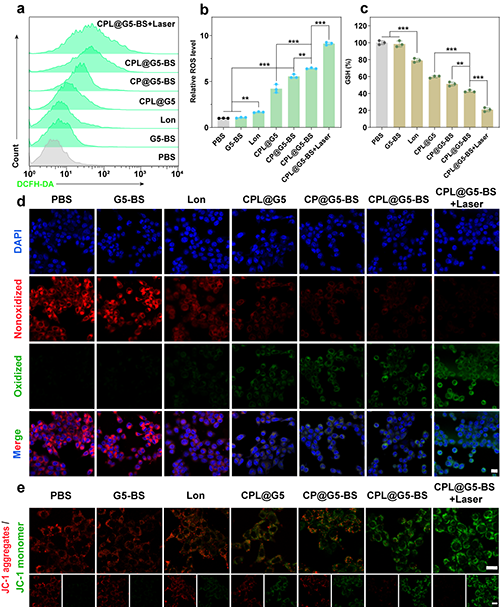
圖5.(a)流式細胞儀分析 4T1 細胞經不同處理 4 小時后的細胞內 ROS 水平和(b)定量分析。(c)不同處理4小時后4T1細胞內GSH的相對水平。(d)通過CLSM觀察不同處理4 h后4T1細胞中LPO的表達水平。(e)4T1細胞經不同處理后的JC-1染色。在(d)和(e)中,標尺 = 20 μm。
團隊進一步評估了Lon對于腫瘤細胞能量代謝的抑制作用。CPL@G5-BS+Laser組腫瘤細胞缺氧得到明顯緩解(圖6a),ATP水平顯著下降(圖6b),HSP90表達顯著降低(圖6c-d)。此外,活/死染實驗證實了CPL@G5-BS在激光照射下對4T1細胞的有效消融。CPL@G5-BS+Laser表現出最高水平的細胞死亡,證實了PTT和催化治療的協同效應(圖6e)。圖6f闡明了CPL@G5-BS的體外抗腫瘤機制。在其被4T1細胞特異性攝取后,可通過多酶活性顯著促進ROS生成、消耗GSH、緩解腫瘤缺氧。同時,Lon可以抑制O2消耗、降低ATP水平、抑制HSP90的表達,從而克服癌細胞的耐熱性。在激光照射下,CPL@G5-BS表現出優異的PTT性能和增強的CDT,從而獲得優異的治療效果。

圖6.(a)使用[Ru(dpp)3]2+Cl2探針檢測不同處理后4T1細胞中的O2含量,標尺 = 20 μm。(b)不同處理4小時后4T1細胞內ATP的相對水平。HSP90表達水平的(c)WB分析和(d)定量結果。(e)不同處理后4T1細胞的Calcein-AM/PI雙染色圖像,標尺 = 50 μm。(f)CPL@G5-BS的抗腫瘤機制。
研究團隊構建了4T1荷瘤小鼠模型,按圖7a所示時間線進行了體內抗腫瘤實驗評價。光熱成像顯示CPL@G5-BS治療組腫瘤部位溫度明顯高于對照組(圖7b)。治療結束后各組小鼠的體重均略有增加,表明材料均沒有明顯的毒性(圖7c)。且CPL@G5-BS+Laser治療組的腫瘤體積最小、重量最輕,說明其具有最佳的腫瘤抑制效果(圖7d-f)。CPL@G5-BS+Laser組小鼠肺轉移結節明顯減少,幾乎接近健康狀態,表明CPL@G5-BS具有顯著的抑制腫瘤轉移的能力(圖7g-h)。
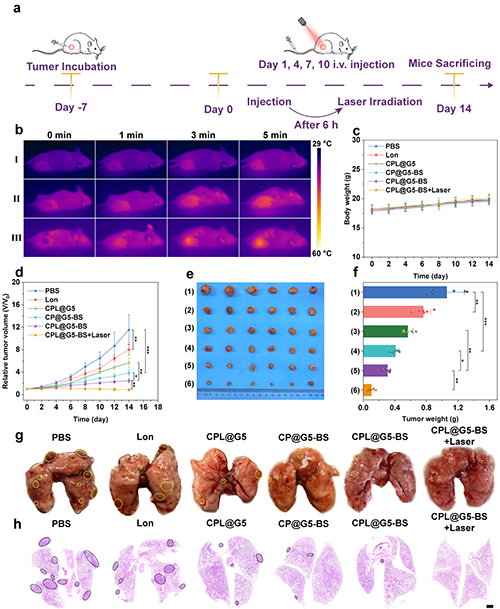
圖7.(a)靜脈注射CPL@G5-BS治療4T1荷瘤小鼠的示意圖。(b)4T1 荷瘤小鼠在 1064 nm 激光照射(0.6 W cm-2)下接受不同治療后的紅外熱成像:Ⅰ)PBS、Ⅱ)CPL@G5、Ⅲ)CPL@G5-BS。不同治療后(c)小鼠體重和(d)相對腫瘤體積的變化。(e)各組切除腫瘤的照片和(f)重量:1)PBS、2)Lon、3)CPL@G5、4)CP@G5-BS、5)CPL@G5-BS、6)CPL@G5-BS + Laser(n = 6)(g)不同處理后第 14 天 4T1 荷瘤小鼠的代表性肺組織照片以及(h)相應的 H&E 染色(標尺 = 1 mm)。
為了比較分析不同治療組之間的腫瘤抑制效果,研究團隊對腫瘤組織切片進行了H&E、TUNEL和Ki67 染色(圖 8a)。結果證明CPL@G5-BS+ Laser 組顯示出最顯著的腫瘤細胞壞死、凋亡,以及最大的腫瘤細胞增殖抑制。免疫熒光染色結果顯示CPL@G5-BS+Laser處理的腫瘤中觀察到了最顯著的CA IX抑制、HIF-1α下調和HSP90抑制(圖8b)。
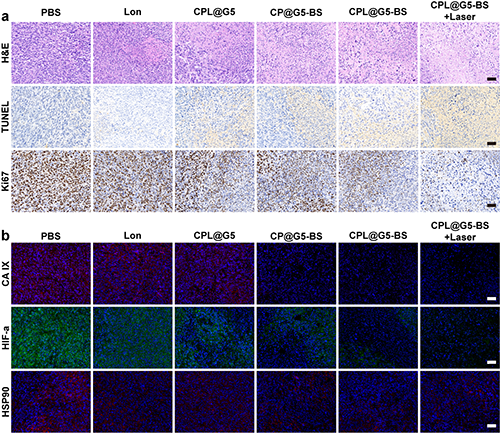
圖8.(a)各組腫瘤組織的 H&E、TUNEL 和 Ki67 染色。(b)不同處理后腫瘤切片的 CA IX、HIF-α、HSP90 染色。在(a)和(b)中,標尺 = 50 μm。
簡而言之,團隊所構建的CPL@G5-BS具有以下特點:1)在 Cu 摻雜和近紅外二區激光照射的共同作用下,CPL@G5-BS展現出增強的級聯催化活性;2)BS修飾使 CPL@G5-BS 在 4T1 腫瘤部位蓄積,并通過抑制 CA IX 活性實現了腫瘤細胞內、外 pH 逆轉,增強了催化治療效果并有效抑制腫瘤轉移;3)Lon通過破壞腫瘤細胞能量代謝、下調 HSP90,克服了 PTT中的熱抵抗效應,同時減少 O2消耗緩解腫瘤乏氧TME。通過調控TME,這種多模式策略不僅促進了激光照射下的有效PTT效果,而且增強了級聯催化治療,從而發揮了顯著的腫瘤抑制作用、抑制腫瘤轉移。
以上研究成果以“Dendrimer-Entrapped CuPt Bimetallic Nanozyme for Tumor Microenvironment Regulated Photothermal/Catalytic Therapy”為題,在線發表于國際著名期刊ACS Applied Materials & Interfaces (DOI: 10.1021/acsami.5c05324)。東華大學生物與醫學工程學院郭睿教授與史向陽教授為共同通訊作者,東華大學碩士研究生盧世轉為第一作者。該工作得到了國家自然科學基金、上海市科學技術委員會等的資助。
論文信息:
Shizhuan Lu, Aiyu Li, Haoyu Huang, Cheng Ni, Xueyan Cao, Xiangyang Shi*, Rui Guo*. Dendrimer-Entrapped CuPt Bimetallic Nanozymes for Tumor Microenvironment-Regulated Photothermal/Catalytic Therapy. ACS Appl Mater Interfaces, 2025, 17: 30716-30730.
文章鏈接:https://doi.org/10.1021/acsami.5c05324
