為實現腫瘤的精準診療,開發腫瘤微環境(TME)刺激響應性成像診斷和藥物遞送的智能納米藥物至關重要。然而,由于腫瘤部位復雜的生理和病理障礙,實現納米藥物的高效腫瘤遞送仍然面臨著巨大挑戰。因此,在開發新型智能診療納米平臺時,需要考慮多種障礙,主要包括免疫清除、網狀內皮系統(RES)引起的滯留效應、高間質液壓力、血管滲漏和淋巴引流不良等。為了克服免疫和RES器官清除,由于癌細胞膜(CCM)上存在免疫片段、抗原和膜錨蛋白,多種CCM包裹的仿生納米平臺被賦予了免疫逃逸和同源腫瘤靶向能力。為了實現精準的成像診斷、有效的腫瘤給藥和降低全身毒副作用,設計TME(酸性pH、過量谷胱甘肽(GSH)等)刺激響應性釋放藥物的智能納米藥物尤為關鍵。
對于納米藥物的開發來說,傳統合成方法存在諸多缺陷,在重復性制備相同理化性質和足夠數量的高質量納米平臺方面顯得力不從心。特別是不同批次的納米平臺差異較大,這嚴重阻礙了其臨床轉化應用。相比之下,微流控技術能夠通過在微米尺度空間操控微流體進行反應,可以精確控制納米平臺的合成過程,包括成核、生長和聚集。微流控作為一種很有前途的技術,具有試劑損耗低、可控制備和一步合成等特點,在合成高質量納米平臺方面具有相當的優勢,能極大助力納米藥物的臨床轉化。
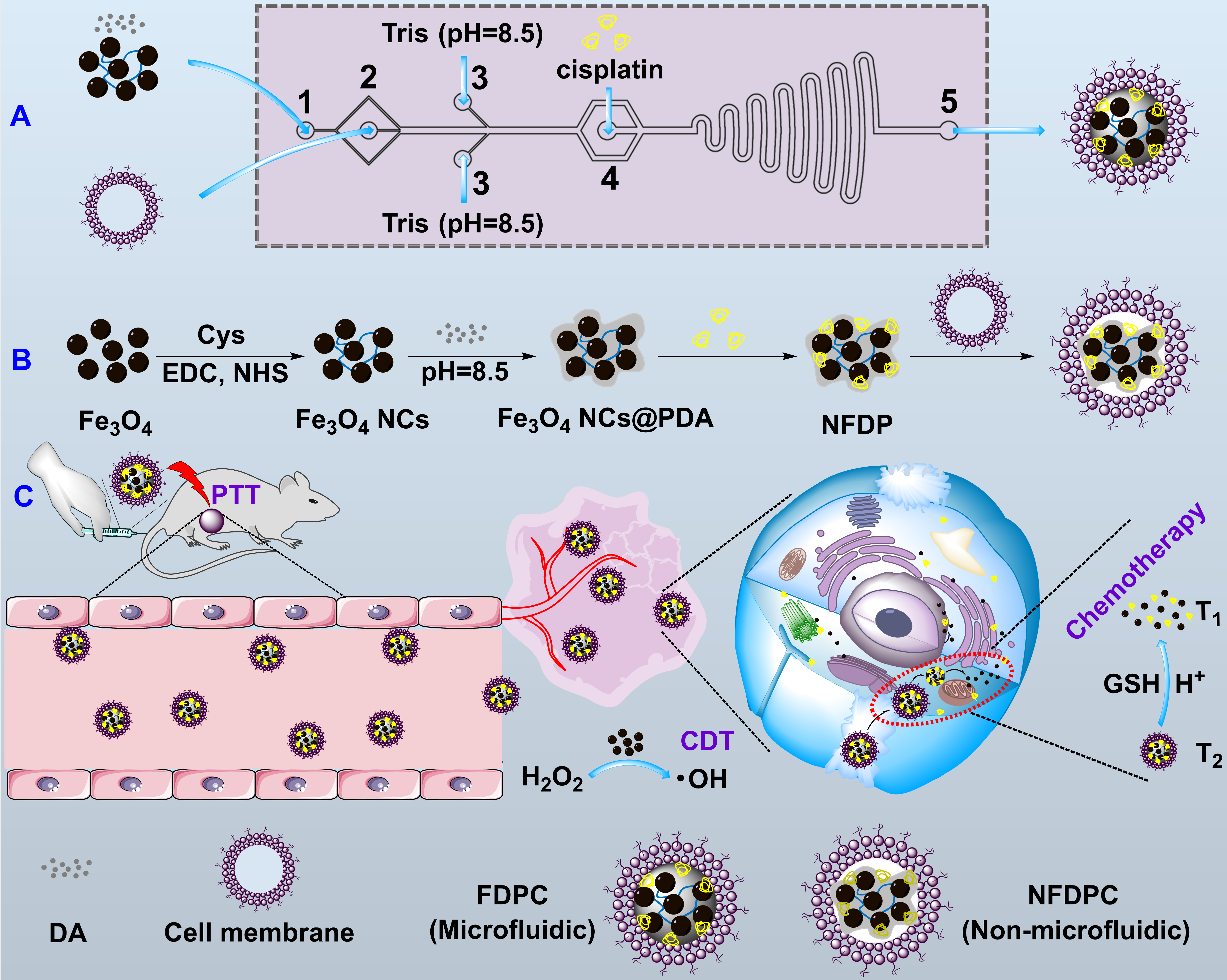
圖1. FDPC的微流控制備(A)和NFDPC的非微流控制備(B)及其用于動態T2/T1 MR成像導引的腫瘤光熱-化學-化學動力學三模態聯合治療的示意圖(C)。

圖2. 不同材料處理的細胞活力檢測結果(A);不同方式處理后細胞內GSH水平變化情況(B);(C-D)不同方式處理后細胞內ROS水平變化情況。
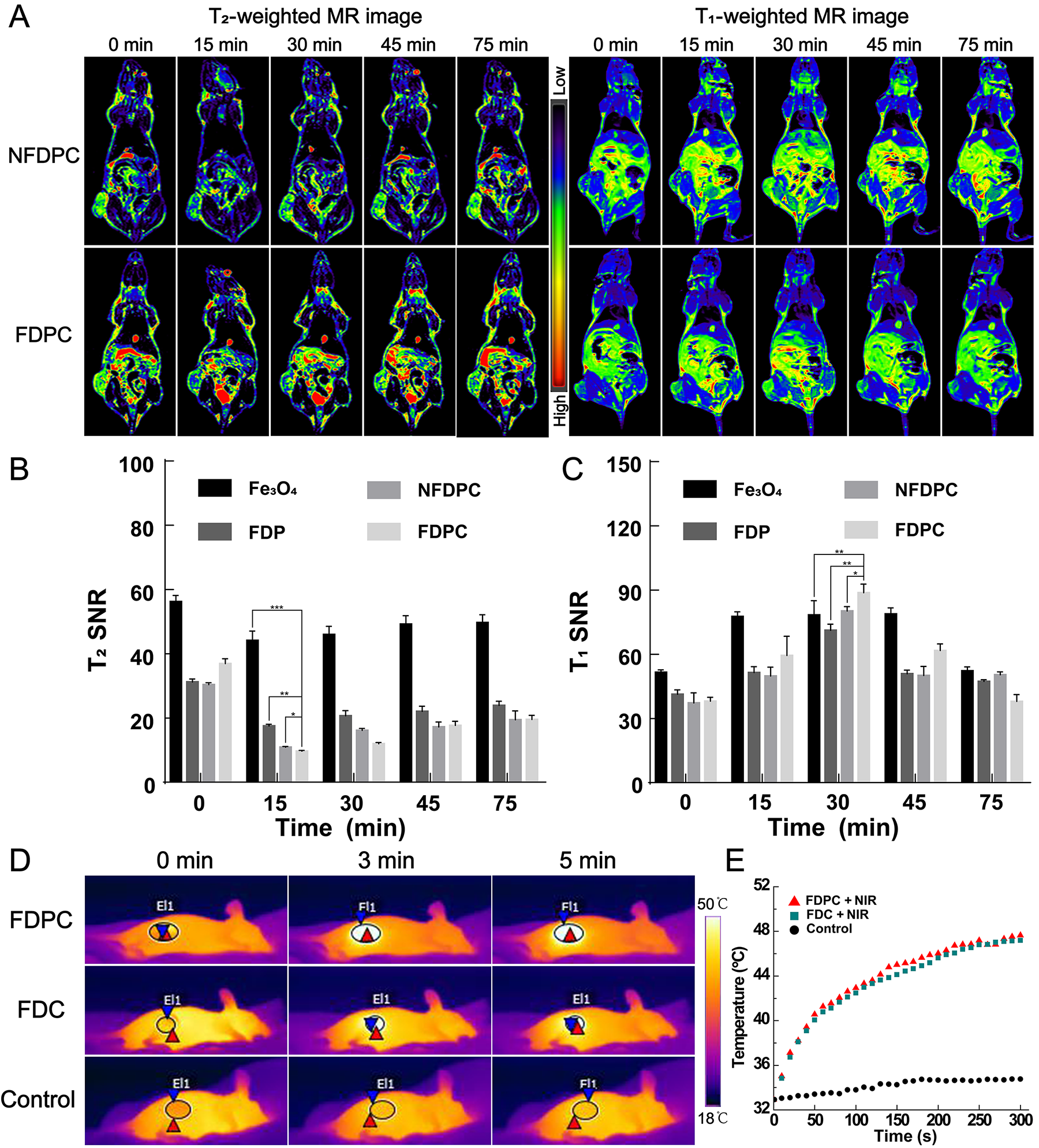

圖4. 小鼠體內治療過程示意圖(A);治療14天內小鼠腫瘤體積及體重變化曲線(B-C);治療第14天腫瘤照片(D);治療第14天腫瘤切片的HE和TUNEL染色結果(E);治療第14天主要臟器切片的HE染色結果(F)。
簡言之,該研究設計的FDPC納米平臺的主要優勢在于以下幾個方面:1)與傳統濕化學方法制備的類似物相比,基于微流控的方法制備的FDPC納米平臺具有更好的均一性、膠體穩定性和TME刺激藥物釋放性能;2)通過二硫鍵的斷裂消耗GSH和基于超小鐵介導的ROS生成,調控腫瘤微環境,降低癌細胞的抗氧化能力,促使癌細胞對藥物和ROS敏感,減少毒副作用;3)FDPC納米平臺具有良好的同源靶向性能、光熱性能和GSH響應的MR成像性能,可用于靶向腫瘤GSH響應的動態T2/T1 MR成像和聯合治療。
論文鏈接:https://doi.org/10.1016/j.nantod.2022.101615
- 中南大學蔣炳炎、吳旺青教授 CEJ:突破微流控芯片模內鍵合技術 2024-12-19
- 哈佛醫學院Y. Shrike Zhang教授團隊 PNAS:閉環模塊化精確控氧多器官芯片系統 2024-11-15
- 北航常凌乾教授等《Biosens. Bioelectron.》:手指驅動式微流控芯片用于結核病的快速多重診斷 2021-09-27
- 港中大(深圳)趙征 / 唐本忠團隊 ACS Nano :多功能AIE納米馬達突破腫瘤屏障 - 實現精準光診療 2025-05-29
- 山東大學欒玉霞教授團隊 Nat. Nanotech.:發現解決CAR-T細胞療法實體瘤療效受限的有效方法 2025-05-20
- 吉大陳學思院士、孫靜教授團隊 JACS:聚類肽輔助因子精準調控熊果酸螺旋納米纖維原位動態組裝實現協同腫瘤增效治療 2025-05-13
- 中科院成都生物所李幫經研究員課題組:雙重腫瘤微環境刺激響應性納米遞藥體系研究獲進展 2017-11-27
