乳腺癌小鼠被近紅外激光照射3分鐘后,早已等候在腫瘤部位的“藥匣子”打開了:抗腫瘤藥物快速均勻地滲透到腫瘤深層組織。4小時后,腫瘤細胞陸續凋亡……
在浙江大學轉化醫學院完成的這一實驗,顯示出一種新型納米載藥系統的巨大威力。抗癌藥搭乘這種納米“載具”,就像鋼鐵俠穿上了那套神奇的裝甲,不僅能在體內待得更久,還能更有效地穿透層層障礙,直達腫瘤深層組織。
浙大醫學院附屬第二醫院和轉化醫學研究院周民研究員團隊取得的這一創新成果日前已發表在著名期刊《先進功能材料》(Advanced Functional Materials),并被編輯部遴選為紙質版封面文章。論文審稿人認為:“這個設計非常吸引人,可能更具有較高的治療價值和轉化前景。”

在實驗室中表現優異的抗癌藥物,用到臨床上效果打折扣,一個關鍵的難題在于:藥物“跑太快”,“跑不遠”。 “跑太快”指的是藥物的代謝速度快,一般情況下,不到24小時藥物就會就被代謝出體外,藥效發揮的時間很短,真正能到達腫瘤的藥物很少。“跑不遠”,是因為腫瘤細胞深層沒有血管分布,而傳統的抗癌藥物分子要通過血管才能到達腫瘤細胞,血管到達不了的地方,也是藥物到達不了的地方。
周民團隊最新設計的多級載藥系統,就是針對臨床上這種現實需求研發的。“藥物+載體”是一種常見的藥物設計方案,科研人員改造了一種廣譜型抗癌藥——阿霉素,讓多個阿霉素小分子搭乘納米顆粒載體,形成一個聚合球。“通過組裝,我們能對這個聚合球進行表面修飾操作,從而調節它在機體內的行為。”論文第一作者、實驗技術員馬飛說,通過這個設計,藥物的個頭變大了,一定程度延長了藥物在機體內停留的時間。
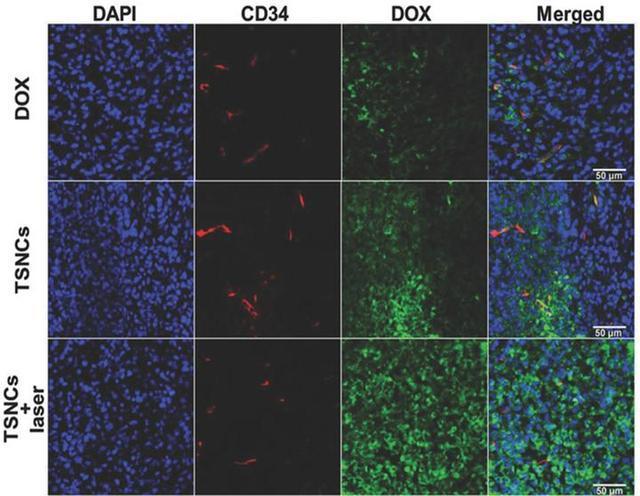
腫瘤組織的免疫熒光染色結果表明,納米聚合球中的阿霉素(綠色熒光)不但可以在腫瘤內血管(紅色熒光)周圍有分布,而且在近紅外激光激發下,可以在腫瘤深層組織具有非常好的分散性,表明阿霉素可以高效的“跑到“深層腫瘤組織
個頭變大還不夠,周民團隊設計的抗癌藥物聚合球還是一種光控的“藥匣子”,這個具有光活性的納米團簇,只有在特定波長的光的激發下,抗癌分子才會釋放擴散。
直徑約40納米的納米團簇通過靜脈注射到乳腺癌小鼠體內,藥物團簇通過血液系統向腫瘤蓄積,24小時后,它們只等體外一束激光的命令。課題組選用的是800納米波長的近紅外光,這種光線的穿透力很強,最多能穿透5厘米左右的生物組織。在光的命令下,納米球解體為超小尺寸的納米點和抗癌分子,在腫瘤組織內部快速滲透。“超小尺寸的納米點和藥物具有較高的滲透能力,因此藥物能夠順利滲透到腫瘤深層組織。”馬飛說。
進一步實驗表明,這種多級載藥系統不但可以高效地摧毀腫瘤細胞,同時還可以顯著抑制腫瘤干細胞的生長。可以在消除原位腫瘤的同時,抑制腫瘤轉移的發生。由于具有較好的腫瘤集聚能力,該系統可以顯著降低抗腫瘤藥物的心臟和系統毒性,具有較高的臨床轉化前景。
需要指出的是,盡管該方法的治療效果讓人鼓舞,但是目前實驗結果仍僅僅在小動物水平得到了驗證。“想要應用于臨床,仍需要大量的試驗。不過可以肯定的是,我們找到了能夠提升腫瘤治療效率和治療安全性的新方法,這是一個正確的研究方向。”周民認為,該項研究工作的研發為未來的精準醫療和個性化藥物發展提供了新的思路,為腫瘤的精準治療提供了一種新的策略。
- 天工大高輝/馬飛賀/余云健 Small:疏水標簽/低溫光熱協同增強腫瘤治療 2025-07-11
- 蘇大鐘志遠/鄧超、蘇大附一院朱曉黎 Nat. Commun.:腫瘤血管適應性、粘附性和可吸收性微球用于可持續的經動脈化學栓塞治療 2025-07-09
- 常州大學王建浩教授團隊《Acta Biomater.》:藥物儲庫型聚合物納米膠束用于腫瘤長效治療的研究成果 2025-07-08
- 四川大學何斌/蒲雨吉 ACS Nano:高分子化丁酸納米平臺治療腸炎 2023-12-24
- 華南理工朱偉 Adv. Sci.:基于紅細胞和MOF-級聯酶的人工生物雜化體用于高尿酸血癥治療 2023-12-17
- 長期有效 | 西南交大周紹兵教授團隊誠招博士、推免碩士 - 材料、生物醫學工程 2023-09-23
