糖尿病慢性傷口因高血糖誘導(dǎo)的線粒體功能障礙、巨噬細(xì)胞極化失衡和血管內(nèi)皮損傷而難以愈合。傳統(tǒng)療法(如清創(chuàng)術(shù)或生長因子局部應(yīng)用)效果有限,且無法解決線粒體動(dòng)態(tài)失衡與免疫代謝交互失調(diào)的核心問題。該研究聚焦于糖尿病慢性傷口愈合難題,開發(fā)了一種絲素蛋白/明膠(SG)基生物水凝膠并負(fù)載線粒體分裂抑制劑Mdivi-1(SG/M),系統(tǒng)探究其促進(jìn)傷口愈合的效果與機(jī)制。糖尿病慢性傷口因代謝紊亂、免疫失調(diào)和微血管損傷導(dǎo)致愈合困難,而線粒體動(dòng)力學(xué)失衡被證實(shí)與糖尿病并發(fā)癥密切相關(guān)。Mdivi-1作為Drp1抑制劑,可抑制線粒體裂變、減輕氧化應(yīng)激和炎癥反應(yīng)。研究通過溶液共混和交聯(lián)工藝制備SG/M水凝膠,其具有三維多孔結(jié)構(gòu)、適宜的機(jī)械強(qiáng)度和緩釋能力,能持續(xù)釋放Mdivi-1并維持局部治療濃度。在糖尿病大鼠模型中,SG/M水凝膠顯著加速傷口閉合,促進(jìn)上皮再生和膠原纖維有序沉積,減少炎癥細(xì)胞浸潤,同時(shí)上調(diào)血管內(nèi)皮生長因子(VEGFα)表達(dá)以增強(qiáng)血管新生。體外實(shí)驗(yàn)表明,高葡萄糖環(huán)境可誘導(dǎo)巨噬細(xì)胞向促炎的M1表型極化,伴隨線粒體碎片化和糖酵解代謝增強(qiáng),而Mdivi-1干預(yù)可逆轉(zhuǎn)這一過程,促進(jìn)巨噬細(xì)胞向抗炎的M2表型極化,恢復(fù)線粒體融合狀態(tài)并促進(jìn)向氧化磷酸化代謝的轉(zhuǎn)變。
機(jī)制研究揭示,Mdivi-1通過激活MEK/ERK信號(hào)通路驅(qū)動(dòng)巨噬細(xì)胞代謝重編程,進(jìn)而促進(jìn)M2極化。更重要的是,Mdivi-1處理的M2型巨噬細(xì)胞可通過細(xì)胞間線粒體轉(zhuǎn)移,將功能性線粒體傳遞給血管內(nèi)皮細(xì)胞(HUVECs),改善后者在高糖環(huán)境下的線粒體膜電位、減少活性氧(ROS)積累,并增強(qiáng)其遷移和管腔形成能力。Transwell共培養(yǎng)實(shí)驗(yàn)證實(shí),線粒體轉(zhuǎn)移依賴于巨噬細(xì)胞的極化狀態(tài),M2型巨噬細(xì)胞傳遞的線粒體可整合到HUVECs的線粒體網(wǎng)絡(luò)中,恢復(fù)其能量代謝功能。此外,SG/M水凝膠的生物相容性良好,系統(tǒng)毒性低,其多孔結(jié)構(gòu)促進(jìn)細(xì)胞黏附與營養(yǎng)交換,為組織修復(fù)提供了理想微環(huán)境。該研究不僅闡明了Mdivi-1通過“巨噬細(xì)胞極化-線粒體轉(zhuǎn)移”軸改善糖尿病微環(huán)境的新機(jī)制,也為糖尿病傷口治療提供了兼具抗炎和促血管生成功能的新型生物材料策略,展現(xiàn)了靶向線粒體動(dòng)態(tài)調(diào)控在代謝性疾病并發(fā)癥中的臨床轉(zhuǎn)化潛力。

圖1. SG/M 水凝膠的制備及其在慢性糖尿病傷口中的作用及機(jī)制示意圖。
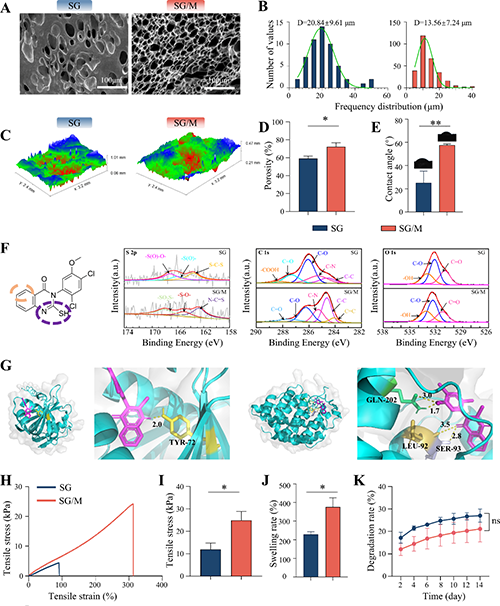
圖2. SG/M水凝膠的結(jié)構(gòu)表征。

圖3. SG/M水凝膠促進(jìn)糖尿病大鼠皮膚傷口愈合。

圖4. 體外巨噬細(xì)胞極化及線粒體動(dòng)力學(xué)分析。
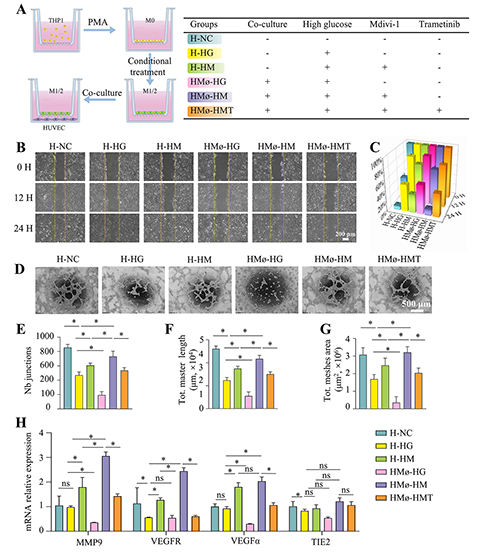
圖5. 體外血管內(nèi)皮細(xì)胞的遷徙行為及成管功能分析。

圖6. 體外血管內(nèi)皮細(xì)胞的線粒體功能分析。

圖7. 巨噬細(xì)胞向血管內(nèi)皮細(xì)胞的線粒體轉(zhuǎn)移。
該工作以“2A-biohydrogels accelerate diabetic wound healing by promoting M2
macrophage polarization and functionalized mitochondrial transfer to endothelial cells”為題發(fā)表于Chemical Engineering Journal(2025:514 ,163130)期刊上(2023 IF=13.4)。文章第一作者為四川大學(xué)華西口腔醫(yī)學(xué)院王浩博士和周敏碩士,通訊作者為四川大學(xué)華西口腔醫(yī)學(xué)院甘雪琦教授。該項(xiàng)研究得到了國家自然科學(xué)基金面上項(xiàng)目的支持。
論文鏈接:https://doi.org/10.1016/j.cej.2025.163130
- 西南林大杜官本教授、楊龍研究員團(tuán)隊(duì) Nat. Commun.:碳化聚合物點(diǎn)誘導(dǎo)結(jié)晶域集成取向調(diào)控構(gòu)建強(qiáng)健和堅(jiān)韌水凝膠 2025-07-07
- 中山大學(xué)吳丁財(cái)/黃榕康/鄭冰娜/王輝團(tuán)隊(duì) Adv. Mater.:具有長駐留性的可注射多孔炭納米酶水凝膠實(shí)現(xiàn)腫瘤的協(xié)同治療 2025-07-04
- 重醫(yī)大毛翔團(tuán)隊(duì)、哈工大賀良燦團(tuán)隊(duì) Small 綜述:復(fù)合水凝膠的創(chuàng)新與應(yīng)用-從聚合物體系到摻金屬離子和功能性納米材料增強(qiáng)型結(jié)構(gòu) 2025-07-04
