近年來,蛋白或基于蛋白的診療試劑(PBTA)受到越來越多科研工作者的關(guān)注。這其中,包括治療蛋白如細胞因子、單抗、生物酶等,可以作為生物大分子藥物,在抗腫瘤治療中表現(xiàn)出優(yōu)良的活性。另外一些則是生物相容性蛋白,如白蛋白、血紅蛋白、轉(zhuǎn)鐵蛋白等,可以作為治療性小分子藥物、染料或診斷劑的載體。然而,目前已報道的蛋白診療劑由于其在腫瘤中蓄積、滲透或選擇性差等種種問題,很大程度上限制了其體內(nèi)應(yīng)用以及臨床轉(zhuǎn)化。我們知道,納米粒子的粒徑在腫瘤滯留、滲透中扮演著至關(guān)重要的角色。通常來講,粒徑較小的納米粒子具有較強的滲透能力,卻同時伴隨著較差的腫瘤滯留;而粒徑較大的粒子恰恰相反,表現(xiàn)出較強滯留及較差滲透。目前已開發(fā)的大部分蛋白診療試劑粒徑均分布在2-20 nm,該小粒子很容易通過腎清除排出體內(nèi),其體內(nèi)生物半衰期不到1小時,使得療效大打折扣。
近期,中國藥科大學(xué)藥學(xué)院孫敏捷教授團隊利用動態(tài)組裝技術(shù),開發(fā)出一種細胞外微環(huán)境ATP超敏蛋白團簇(DEP/GdCuB)成功攻克這一瓶頸,同時實現(xiàn)了蛋白粒子在腫瘤部位有效蓄積及深層滲透,并用于放大T1加權(quán)磁共振成像(MRI)引導(dǎo)的光熱治療(圖1)。這一成果近日發(fā)表于Advanced Functional Materials雜志。
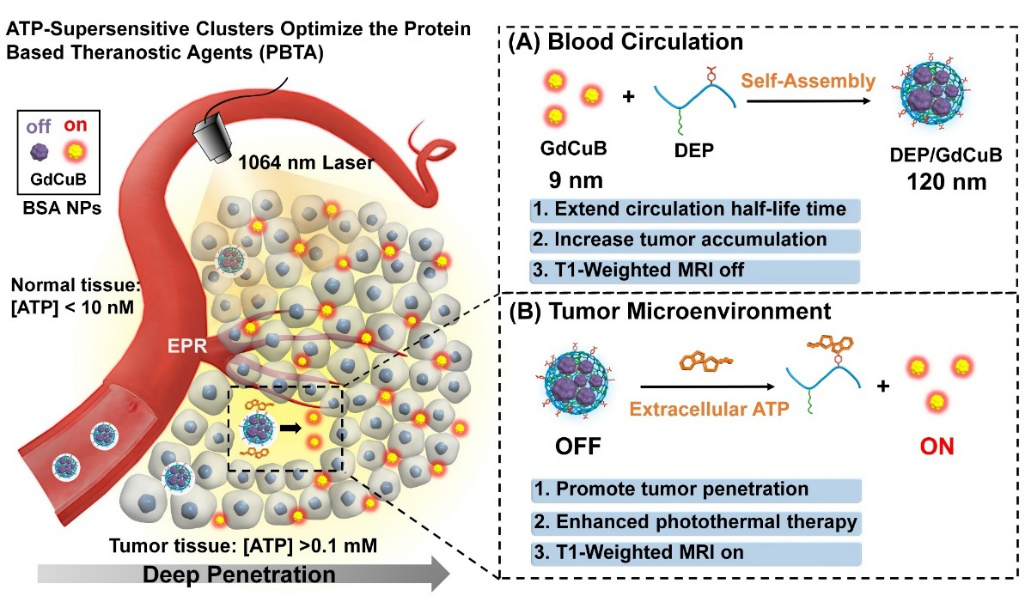
圖1. 胞外ATP超敏型蛋白團簇(DEP/GdCuB)制備及在體內(nèi)工作原理示意圖:(A)在血液循環(huán)中:將荷載Gd和CuS的白蛋白納米小粒子(9 nm)制備成蛋白團簇(120 nm),能夠有效延長蛋白的血液循環(huán)時間,從而增強其在腫瘤部位蓄積,與此同時,制備成較大粒子能夠減弱Gd的T1加權(quán)MRI效果,降低背景信號;(B)當(dāng)?shù)鞍讏F簇到達腫瘤部位,腫瘤微環(huán)境0.1-0.4mM ATP能夠迅速反轉(zhuǎn)DEP陽離子材料電荷,觸發(fā)蛋白小粒子釋放,實現(xiàn)深層滲透的同時,“大變小”策略激活Gd的T1加權(quán)MRI成像,點亮腫瘤,實現(xiàn)MRI引導(dǎo)的光熱治療。
腫瘤微環(huán)境(0.1-0.4 mM)及腫瘤細胞內(nèi)(1-10 mM)均富含ATP分子,課題組前期研究發(fā)現(xiàn),ATP分子中同時包含能與苯硼酸(PBA)特異結(jié)合的二醇分子以及強負電性三磷酸分子,修飾苯硼酸的陽離子聚合物能夠在富含ATP環(huán)境下迅速實現(xiàn)電荷反轉(zhuǎn)(正轉(zhuǎn)負),通過靜電排斥觸發(fā)負電性siRNA釋放。基于上述概念,孫敏捷教授團隊成功開發(fā)出能夠針對腫瘤細胞內(nèi)高濃度ATP選擇性激活的siRNA轉(zhuǎn)染載體(ACS Appl. Mater. Interfaces 2018, 10, 32026?32037;Theranostics 2018; 8(17): 4604-4619)。進一步研究發(fā)現(xiàn),很多生物大分子藥物,如蛋白中也包含負電性區(qū)域,因此,該ATP敏感體系在蛋白遞送中是否同樣具有應(yīng)用前景值得進一步探究。
首先,該團隊在天然多糖糊精上修飾乙二胺作為陽離子材料,同時修飾不同取代度的苯硼酸,以調(diào)節(jié)ATP敏感性,得到ATP敏感載體DEP。將Gd和CuS分別作為MRI成像模塊以及光熱治療元件包載在BSA納米粒中,形成診療一體化蛋白小粒子(GdCuB)。蛋白小粒子包裹在DEP材料中,形成蛋白團簇DEP/GdCuB。最終通過篩選,選取較高PBA取代度的DEP材料用于實驗,實驗證明其具有ATP超敏感性能,能夠快速響應(yīng)腫瘤微環(huán)境0.1 mM ATP。如圖2A所示,加入ATP后,DEP發(fā)生電荷反轉(zhuǎn),從而導(dǎo)致GdCuB蛋白的快速釋放(圖2B)。從TEM形貌觀察中也能發(fā)現(xiàn),GdCuB為9 nm,DEP/GdCuB為120 nm左右,同時,在團簇中加入ATP后, 大量小粒子從團簇中釋放(圖2C),證明了ATP可觸發(fā)團簇解體及蛋白釋放。通常來講,將T1成像劑Gd包載在小粒徑BSA中,由于其具有較大的比表面積,能夠大大縮短弛豫時間,因此具有很 好的成像效果;而形成團簇之后,比表面積減小,Gd離子與水分子接觸幾率降低,成像效果減弱。這里,通過血液循環(huán)中“小變大”和腫瘤微環(huán)境“大變小”的動態(tài)組裝策略,能夠?qū)崿F(xiàn)腫瘤區(qū)域ATP選擇性激活T1成像效果(圖3A,3B)。更值得一提的是,“小變大”與“大變小”的動態(tài)組裝能夠同時實現(xiàn)腫瘤的蓄積與深層滲透(圖3C)。此項研究工作不僅提供了一種平衡納米粒子在腫瘤滲透及滯留的新策略,而且為下一代蛋白診療試劑的開發(fā)提供了一個實例,對優(yōu)化蛋白診療試劑的臨床應(yīng)用具有重要的參考意義。此外,該策略是否能夠普適的應(yīng)用于表面負電性修飾的納米粒子(如:Fe3O4, 金納米,量子點等),仍然值得進一步探究。

圖2. (A)ATP觸發(fā)陽離子材料DEP電荷反轉(zhuǎn)示意圖;(B)ATP觸發(fā)蛋白小粒子GdCuB釋放;(C)TEM觀察蛋白小粒子和蛋白團簇形態(tài),以及加入ATP后團簇形態(tài)變化。

圖3. (A)不同濃度GdCuB、DEP/GdCuB以及DEP/GdCuB+ATP溶液的T1加權(quán)磁共振成像;(B)T1加權(quán)磁共振成像弛豫系數(shù)計算;(C)3D腫瘤細胞球觀察DEP/GdCuB-FITC蛋白團簇在有無ATP存在下的滲透。
中國藥科大學(xué)博士生周占威為本論文第一作者,孫敏捷教授為本文的通訊作者。
該研究得到了國家重點研發(fā)計劃“納米專項”(2017YFA0205402)、國家自然科學(xué)基(81872817, 81573377, 81803477)、江蘇省杰出青年基金(BK20170028)等資助。
論文題目為“Size Switchable Nanoclusters Fueled by Extracellular ATP for Promoting the Deep Penetration and MRI Guided Tumor Photothermal Therapy”https://doi.org/10.1002/adfm.201904144
- 東華大學(xué)史向陽教授/沈明武研究員團隊 AFM: 雙驅(qū)動納米馬達用于高效腫瘤光熱治療及治療后炎癥緩解 2025-03-17
- 香港科大唐本忠院士團隊/武大王富安課題組 JACS:設(shè)計一種AIE螺環(huán)近紅外發(fā)射探針用于DNAzyme敏化增強的乳腺癌光熱治療 2024-12-14
- 北航潘曹峰教授/河南大學(xué)曹瑞瑞副教授團隊 AFM:用于運動能量收集和光熱治療的摩擦電功能紡織品 2024-12-07
- 天工大高輝/馬飛賀/余云健 Small:疏水標(biāo)簽/低溫光熱協(xié)同增強腫瘤治療 2025-07-11
- 蘇大鐘志遠/鄧超、蘇大附一院朱曉黎 Nat. Commun.:腫瘤血管適應(yīng)性、粘附性和可吸收性微球用于可持續(xù)的經(jīng)動脈化學(xué)栓塞治療 2025-07-09
- 常州大學(xué)王建浩教授團隊《Acta Biomater.》:藥物儲庫型聚合物納米膠束用于腫瘤長效治療的研究成果 2025-07-08
- 西工大李鵬教授課題組 Sci. Adv.:可選擇性殺滅ESKAPE耐藥菌的含氟兩親性陽離子聚合物 2024-09-01
