近日,南京大學(xué)現(xiàn)代工程與應(yīng)用科學(xué)學(xué)院生物醫(yī)學(xué)工程系胡勇教授課題組和南京大學(xué)化學(xué)與化工學(xué)院高分子化學(xué)專業(yè)蔣錫群教授課題組應(yīng)邀撰寫了題為“Recent Advances in Nanostrategies Capable of Overcoming Biological Barriers for Tumor Management”的綜述性文章,系統(tǒng)性探討了輔助納米藥物載體逐級(jí)克服生理性/癌癥病理性屏障的策略。該綜述于10月30日在線發(fā)表于Wiley旗下材料學(xué)專業(yè)期刊Advanced Materials (DOI:10.1002/adma.201904337)。胡勇教授和蔣錫群教授為本文的共同通訊作者,現(xiàn)代工程與應(yīng)用科學(xué)學(xué)院2015屆的霍達(dá)博士為本文的第一作者。
本文主要聚焦納米藥物從接觸腫瘤組織開始至富集于癌細(xì)胞內(nèi)與特定靶點(diǎn)所作用的全過程中所可能遭遇的生理性/病理性屏障以及近年來所發(fā)展的應(yīng)對(duì)策略。從組織和細(xì)胞兩個(gè)層面分別討論了納米藥物需要克服的生理屏障。
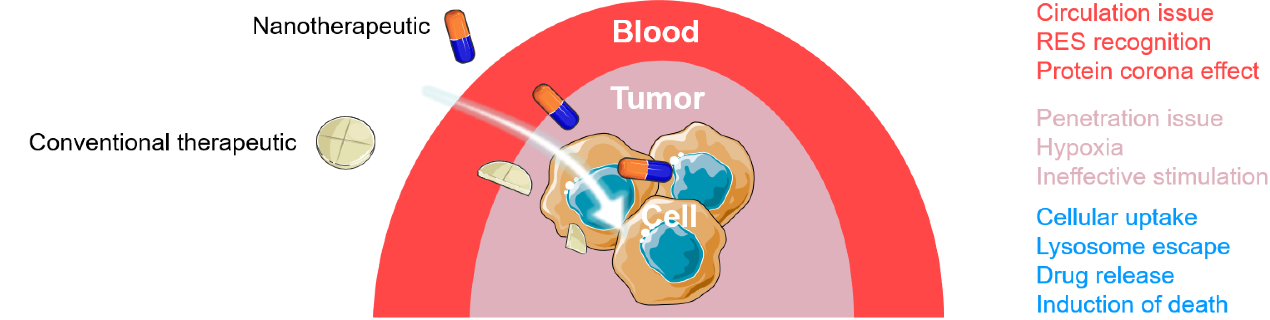
組織層面潛在屏障
1. 腫瘤代謝廢物積累造成的高間質(zhì)壓力
后果:高壓力微環(huán)境抑制了納米材料向腫瘤深層滲透
解決策略:
-
促進(jìn)腫瘤血管正常化,促進(jìn)代謝廢物清除
-
引入形態(tài)可變性納米載體 (腫瘤觸發(fā)尺寸坍縮 versus 集束炸彈型納米載體)
-
以生物質(zhì)作為載體,利用其天然靶向性克服間質(zhì)壓力
2. 癌細(xì)胞及細(xì)胞外基質(zhì)導(dǎo)致的固體壓力
后果:形成物理性屏障抑制納米材料的瘤內(nèi)輸運(yùn)
解決策略:
-
抗細(xì)胞間質(zhì)治療-化療序貫治療
-
透明質(zhì)酸酶/膠原酶與化療藥物共同遞送,程序性釋放
3. 乏氧性腫瘤微環(huán)境
后果:顯著削弱光動(dòng)力治療/放射線等氧依賴型療法對(duì)于癌細(xì)胞殺傷
解決策略:
-
化療/光動(dòng)力治療/射線增敏劑與氧氣的共同遞送
-
以腫瘤代謝廢物為原料原位制造氧氣緩解乏氧
-
抑制癌細(xì)胞經(jīng)由氧化磷酸化的氧消耗
-
乏氧微環(huán)境激活型化療藥物
4. 藥物載體激勵(lì)源低組織穿透
后果:納米藥物無法被充分激發(fā),顯著影響藥效
解決策略:
-
利用化學(xué)發(fā)光/切倫科夫輻射從瘤內(nèi)激活納米載體
-
以X射線為光動(dòng)力治療的激勵(lì)源
-
采用微波輻射引發(fā)深層組織熱療
細(xì)胞層面潛在屏障
1. 內(nèi)吞障礙
后果:納米材料被排除于細(xì)胞外,釋放的藥物無法作用與預(yù)定靶點(diǎn)
解決策略:
-
主動(dòng)調(diào)控蛋白冠效應(yīng),構(gòu)建細(xì)胞內(nèi)吞有利型蛋白冠
-
調(diào)控納米載體結(jié)構(gòu),增強(qiáng)材料-細(xì)胞膜結(jié)合力
2. 溶酶體逃逸
后果:載體內(nèi)負(fù)載蛋白/小分子藥物被降解或材料經(jīng)由溶酶體介導(dǎo)的外排而清除
解決策略:
-
引入溶酶體膜穿透性配體
-
引入局部電荷促進(jìn)納米材料穿膜
-
借鑒病毒溶酶體逃逸思路
3. 細(xì)胞內(nèi)短滯留期
后果:載體在藥物釋放前被細(xì)胞所清除
解決策略:
-
經(jīng)由癌細(xì)胞高表達(dá)酶促進(jìn)載體在細(xì)胞內(nèi)實(shí)現(xiàn)自組裝,增大尺寸
-
載體與細(xì)胞內(nèi)細(xì)胞器產(chǎn)生正交反應(yīng)
-
載體形態(tài)由各向同性轉(zhuǎn)為各向異性,抑制外排
4. 凋亡抗性
后果:誘導(dǎo)程序性死亡為主的納米藥物藥效被抑制
解決策略:誘導(dǎo)非凋亡型死亡如鐵死亡,程序性壞死及自噬等
5. 多藥耐藥性
后果:細(xì)胞胞漿內(nèi)藥物濃度顯著低于致死劑量
解決策略:
-
引入siRNA或小分子藥物外排泵抑制劑協(xié)同化療
-
耗竭細(xì)胞內(nèi)ATP,抑制藥物外排泵工作
-
在特定細(xì)胞器實(shí)現(xiàn)藥物釋放
該論文系統(tǒng)的討論了納米藥物從到達(dá)腫瘤組織開始至在細(xì)胞內(nèi)成功發(fā)揮藥效過程中可能遭遇的屏障及相應(yīng)的對(duì)策。目前對(duì)于這些屏障對(duì)于納米載體發(fā)揮藥效的抑制效果尚無定論,依據(jù)腫瘤發(fā)病部位以及病變進(jìn)程的差異,每一種生理學(xué)/病理學(xué)屏障均可能扮演關(guān)鍵性角色。如無實(shí)體形態(tài)的血液系統(tǒng)癌癥更應(yīng)當(dāng)關(guān)注納米載體對(duì)于癌變細(xì)胞的識(shí)別能力,而對(duì)于應(yīng)用于胰腺癌治療的納米載體而言,其克服腫瘤間質(zhì)的能力尤為重要。依靠現(xiàn)有技術(shù),尚無法在合理成本范圍內(nèi)開發(fā)能夠克服前述所有屏障的納米藥物,因此,因病制宜的構(gòu)建個(gè)性化納米載體是未來納米藥物走向臨床需要遵循的一個(gè)原則。同時(shí),目前針對(duì)癌癥疾病發(fā)展過程中出現(xiàn)的屏障效應(yīng)所設(shè)計(jì)的藥物載體也為具有相似病理學(xué)特點(diǎn)如炎癥,感染等疾病的治療提供了參考。
論文鏈接:https://onlinelibrary.wiley.com/doi/abs/10.1002/adma.201904337
- 中科大王育才/蔣為團(tuán)隊(duì) Nat. Biomed. Eng.: 利用一氧化氮(NO)突破腫瘤血管基底膜屏障,增強(qiáng)納米藥物瘤內(nèi)遞送 2025-05-03
- 川大李旭東/陳君澤、港城大譚超良團(tuán)隊(duì) Adv. Mater.: 多酚-氨基酸縮合物庫用于超高載藥量納米藥物的高通量連續(xù)流生產(chǎn) 2025-02-12
- 天工大高輝/李曉暉團(tuán)隊(duì) Acta Biomater.:二甲雙胍多功能納米藥物克服具核梭桿菌介導(dǎo)的結(jié)直腸癌化療耐藥與免疫抑制 2025-02-11
- 四川大學(xué)何斌/蒲雨吉 ACS Nano:高分子化丁酸納米平臺(tái)治療腸炎 2023-12-24
- 華南理工朱偉 Adv. Sci.:基于紅細(xì)胞和MOF-級(jí)聯(lián)酶的人工生物雜化體用于高尿酸血癥治療 2023-12-17
- 長(zhǎng)期有效 | 西南交大周紹兵教授團(tuán)隊(duì)誠(chéng)招博士、推免碩士 - 材料、生物醫(yī)學(xué)工程 2023-09-23
- 《ANGEW》VIP&封面綜述:胰島素口服遞送平臺(tái)及其克服生理屏障的應(yīng)對(duì)策略 2020-09-10
