近日,中山大學材料學院帥心濤教授團隊在2月5日出版的Science子刊Science Advances上發表了他們在納米材料腫瘤免疫治療研究中取得的重要突破。
目前,免疫檢查點阻斷已經成為腫瘤免疫治療中最具吸引力和最有效的手段之一。其中,通過阻斷PD-1/PD-L1免疫檢查點,激活T細胞來抑制腫瘤生長的治療方法,在黑色素瘤和其他多種類型腫瘤的臨床治療中取得了巨大的療效。但是,由于腫瘤微環境中存在多種免疫逃逸和免疫抑制的機制,仍然有超過一半的腫瘤患者不能響應阻斷PD-1/PD-L1免疫檢查點的免疫治療。同時,雖然納米藥物遞送體系在協同提高免疫治療效果的研究中越來越受到關注,但僅僅依靠納米藥物的被動聚集(EPR效應)來實現腫瘤的藥物聚集往往比預期的效果更差。因此,納米藥物在免疫治療方面的治療潛力依然受到了極大的限制。
為了克服納米材料在腫瘤免疫治療研究中遇到的這兩大挑戰,帥心濤教授團隊開發了一種新的方案。考慮到血液循環中的表達PD-1的T細胞(PD-1+T細胞)可以靶向結合aPD-1抗體,然后通過趨化因子的作用主動向炎癥或者腫瘤部位聚集,他們設計了一種新的納米藥物遞送策略(圖1),不僅可以利用納米載體遞送aPD-1抗體用于免疫檢查點的阻斷,而且還可以利用T細胞來遞送NF-κB信號通路抑制劑用于抗腫瘤T淋巴細胞的募集。由于納米載體pH的敏感性,腫瘤浸潤的PD-1+ T細胞結合的納米藥物在酸性的腫瘤微環境中釋放,留下aPD-1封閉抗腫瘤T細胞上的PD-1/PD-L1免疫檢查點,新產生的負載NF-κB信號通路抑制劑的納米藥物被腫瘤細胞和腫瘤相關巨噬細胞攝取,從而抑制腫瘤細胞和腫瘤相關巨噬細胞的NF-κB信號通路,進一步增加抗腫瘤T淋巴細胞的募集,這些募集來的T細胞又可以再次作為納米藥物輸送的工具輸送納米藥物,這種良性的藥物遞送循環可以顯著提升腫瘤內藥物的聚集,改善腫瘤中T細胞的浸潤,協同提升腫瘤免疫治療的效果,為一些不響應免疫檢查點治療的腫瘤提供了一個新的方向。
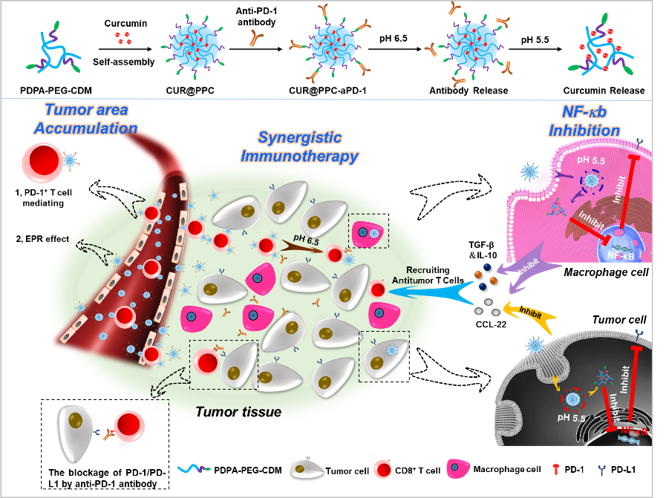
圖1. 雙pH敏感的納米藥物的制備及腫瘤的靶向輸送策略 (Shuai et al., 2020, Sci. Adv.)
該研究工作受到國家973計劃項目基金,國家自然科學基金, 廣東省自然科學基金和廣東省創新創業團隊項目基金的資助。中山大學材料科學與工程學院的帥心濤教授為本研究的通訊作者,博士生肖澤聰為本研究的第一作者,第一單位為中山大學材料科學與工程學院。該研究以“Dual pH-sensitive nanodrug blocks PD-1 immune checkpoint and uses T cells to deliver NF-κB inhibitor for antitumor immunotherapy”為題在線發表在國際綜合學術期刊Science Advances上。
- 港中大(深圳)趙征 / 唐本忠團隊 ACS Nano :多功能AIE納米馬達突破腫瘤屏障 - 實現精準光診療 2025-05-29
- 山東大學欒玉霞教授團隊 Nat. Nanotech.:發現解決CAR-T細胞療法實體瘤療效受限的有效方法 2025-05-20
- 吉大陳學思院士、孫靜教授團隊 JACS:聚類肽輔助因子精準調控熊果酸螺旋納米纖維原位動態組裝實現協同腫瘤增效治療 2025-05-13
- 東華大學史向陽教授 Nano Today:仿生金屬-多酚網絡包覆彈性蛋白樣多肽膠束實現原位腦膠質瘤的聲動力/化學動力/免疫治療 2025-05-28
- 南華大學魏華/喻翠云/張海濤團隊 CRPS:環刷拓撲結構球形核酸通過中性粒細胞極化增強肝細胞癌基因-免疫治療 2025-05-04
- 蘇大劉莊/楊光保教授團隊招聘博士后 - 材料合成、納米醫學(腫瘤診療、藥物遞送、免疫治療等) 2025-04-29
