天然多糖來源于自然界中的動植物,在自然界中儲備豐富。天然多糖通常具有良好的生物相容性、可降解性。根據天然多糖的不同特性,可將其進行結構修飾,制備功能化的藥用高分子材料。可以提高疏水藥物的水溶性,提高藥物的生物利用度和靶向性。隨著人們環保與安全意識的提高,利用天然多糖代替合成高分子材料作為藥物載體的優勢越來越明顯。
山東省泰山學者青年專家,煙臺大學博士生導師、陳大全教授團隊在基于天然多糖和天然活性產物的藥物遞送系統的研究方面取得重要進展,并將該遞送系統分別用于動脈粥樣硬化和腫瘤的治療。相關工作先后在Carbohydrate Polymers發表,以“Novel dual ROS-sensitive and CD44 receptor targeting nanomicelles based on oligomeric hyaluronic acid for the efficient therapy of atherosclerosis”和“In vitro/vivo evaluation of novel mitochondrial targeting charge-reversal polysaccharide-based antitumor nanoparticle”為題,煙臺大學陳大全教授為通訊作者,煙臺大學碩士研究生侯曉雅和房蕾分別為論文第一作者。
1.基于低聚透明質酸的具有雙重ROS響應和CD44受體靶向的藥物遞送系統在動脈粥樣硬化治療中的應用
課題組研究設計合成了一種具有雙重ROS響應和CD44受體靶向特性的兩親性載體聚合物,透明質酸-硫縮酮鍵-二茂鐵(HASF),負載中藥姜黃素,形成載藥膠束,用于動脈粥樣硬化的治療。
對于載體材料的作用及釋藥機理,課題組依據透明質酸對斑塊處巨噬細胞表面CD44受體的高親和性,設想載體可以實現對斑塊部位的靶向作用。再利用斑塊處特異的高活性ROS微環境下,載體聚合物中硫縮酮鍵的自動斷裂,實現化學反應性藥物釋放;二茂鐵中疏水性的Fe會被氧化成親水性的Fe離子,打破載體聚合物的親疏水平衡,實現膠束自主解離,藥物釋放,來提高斑塊內藥物有效濃度以及保證藥物在斑塊局部釋放藥物。
體內油紅O實驗結果表明,相較于模型組和游離藥組,制劑組的病變面積有明顯減少,證明此載體材料對動脈粥樣硬化的治療有一定作用,ROS響應性納米顆粒有望用于炎癥疾病的靶向治療。

圖1 雙重ROS響應和CD44受體靶向性的納米藥物遞送系統的藥物釋放機制圖
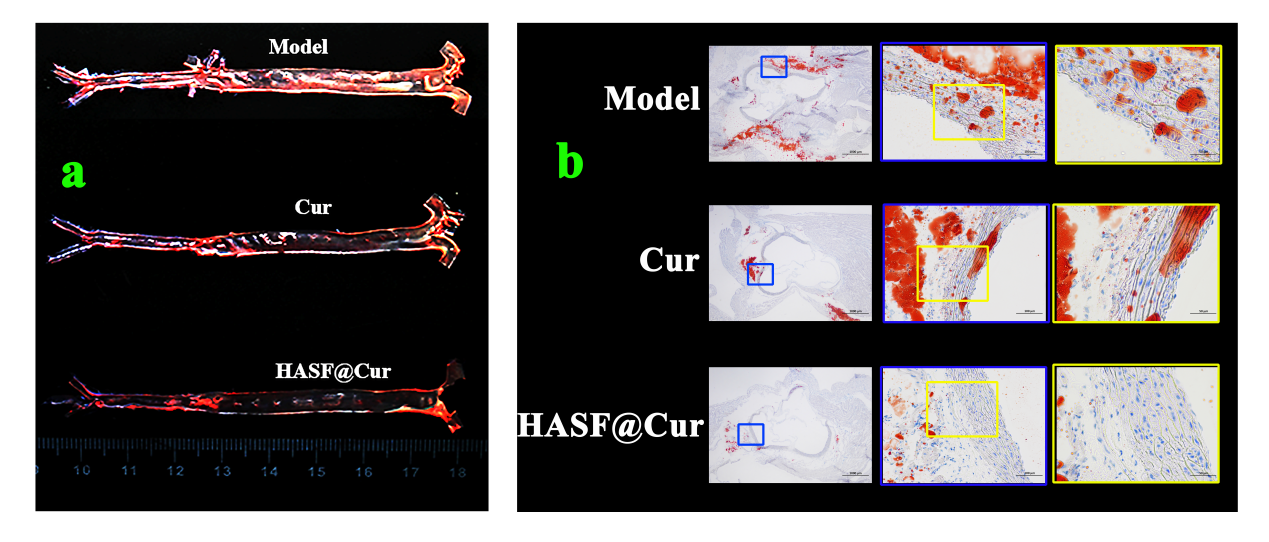
圖2 大鼠AS模型的建立。(a)大鼠主動脈樹的大體油紅O染色結果; (b)大鼠主動脈冰凍切片油紅O染色結果。
2. 基于殼寡糖和當歸多糖的線粒體靶向電荷反轉納米粒子在腫瘤治療中的研究
殼寡糖是天然多糖殼聚糖的低聚物,其保留了殼聚糖的優良特性,并改善了殼聚糖的水溶性。當歸多糖是從當歸根部提取的水溶性多糖,具有良好的水溶性及抗腫瘤效果。本實驗以優異水溶性的陽離子多糖殼寡糖為基礎,對殼寡糖的氨基進行結構修飾,合成了一種帶正電荷的沒食子酸-殼寡糖-二硫鍵-小檗堿聚合物(GA-CDB)。通過自組裝,GA-CDB最終形成了負載姜黃素(Cur)的還原響應性陽離子膠束(GA-CDB@Cur)。隨后合成帶負電荷的當歸多糖與苯硼酸的連接物(AS-PBA),用于屏蔽陽離子膠束內核的正電荷、并賦予納米粒子腫瘤唾液酸受體靶向能力,制備殼核結構的納米粒子AS-PBA/GA-CDB@Cur用于腫瘤治療。該納米粒子殼與核之間的結合主要是基于陽離子多糖殼寡糖和陰離子多糖當歸多糖的靜電相互作用以及多糖表面修飾的苯硼酸與沒食子酸之間形成的pH反應硼酸酯鍵。
研究表明,AS-PBA的保護使AS-PBA/GA-CDB@Cur納米粒子一方面具有具有良好的生理穩定性和靶向能力;另一方面在模擬腫瘤微環境的介質中具有電荷反轉能力。在到達腫瘤部位后,硼酸酯鍵同時在酸性腫瘤微環境和溶酶體中斷裂,暴露帶正電荷的GA-CDB@Cur膠束核心,實現有效的細胞攝取、有效的溶酶體逃逸和準確的線粒體定位。并可進一步誘導線粒體膜電位的下降,啟動腫瘤細胞的凋亡路徑。體內實驗結果表明,核殼納米粒子有效地將藥物傳遞到腫瘤部位,顯著延長了藥物在腫瘤組織中的保留時間,具有良好的抗腫瘤活性。
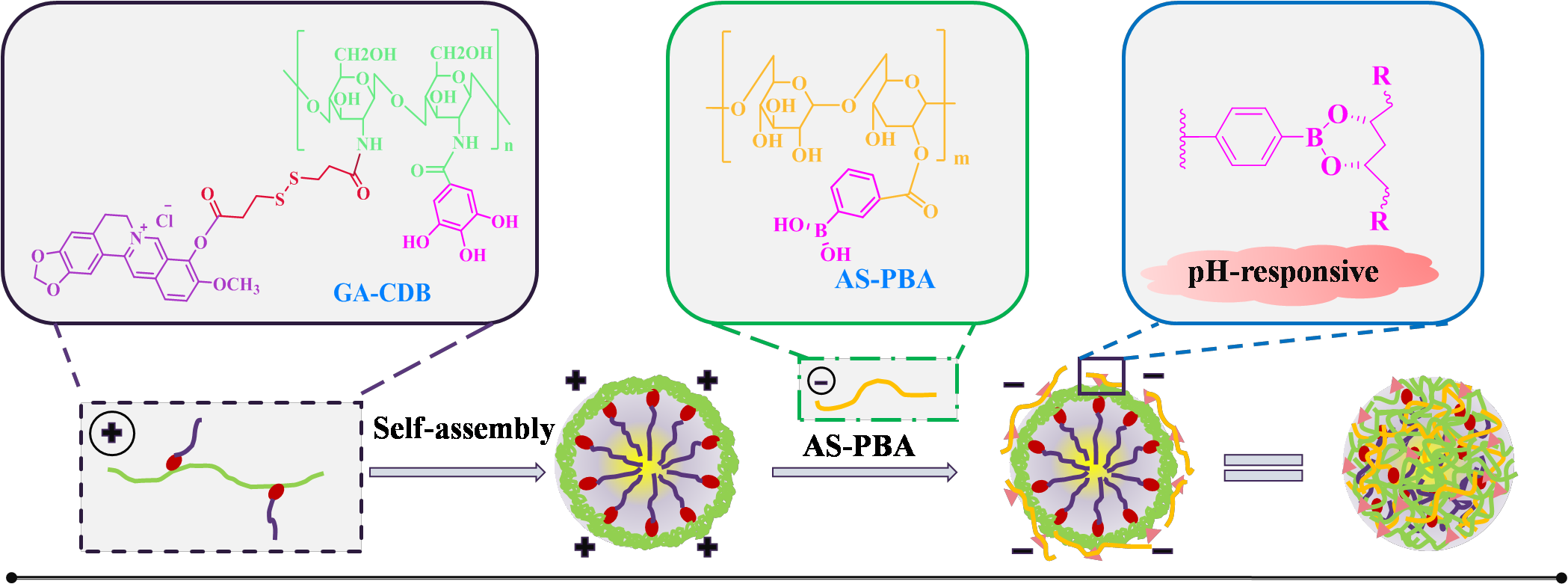
圖3 AS-PBA/GA-CDB@Cur納米粒子的組成示意圖
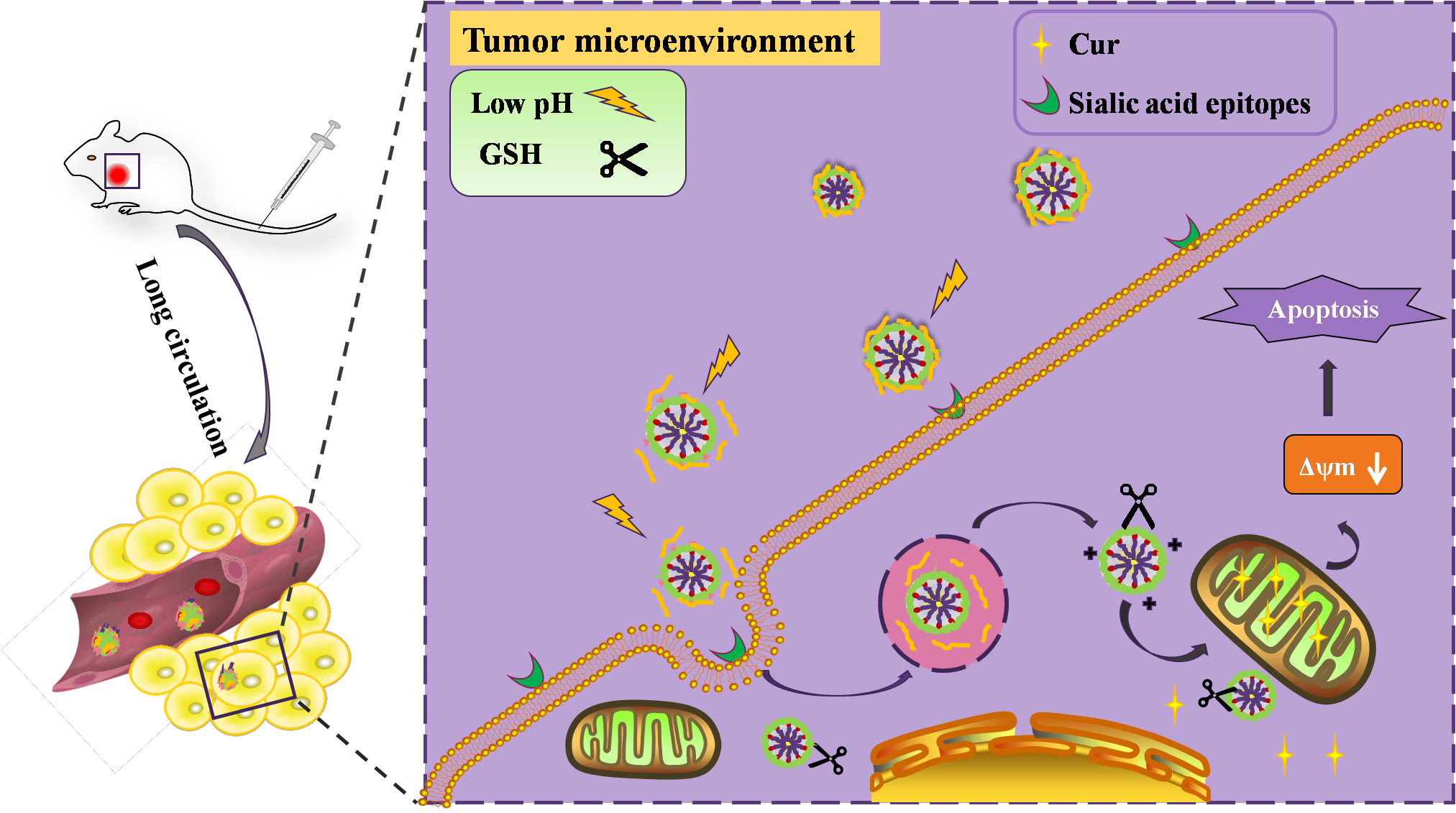
圖4 納米粒子延長血液循環及細胞內藥物遞送示意圖。
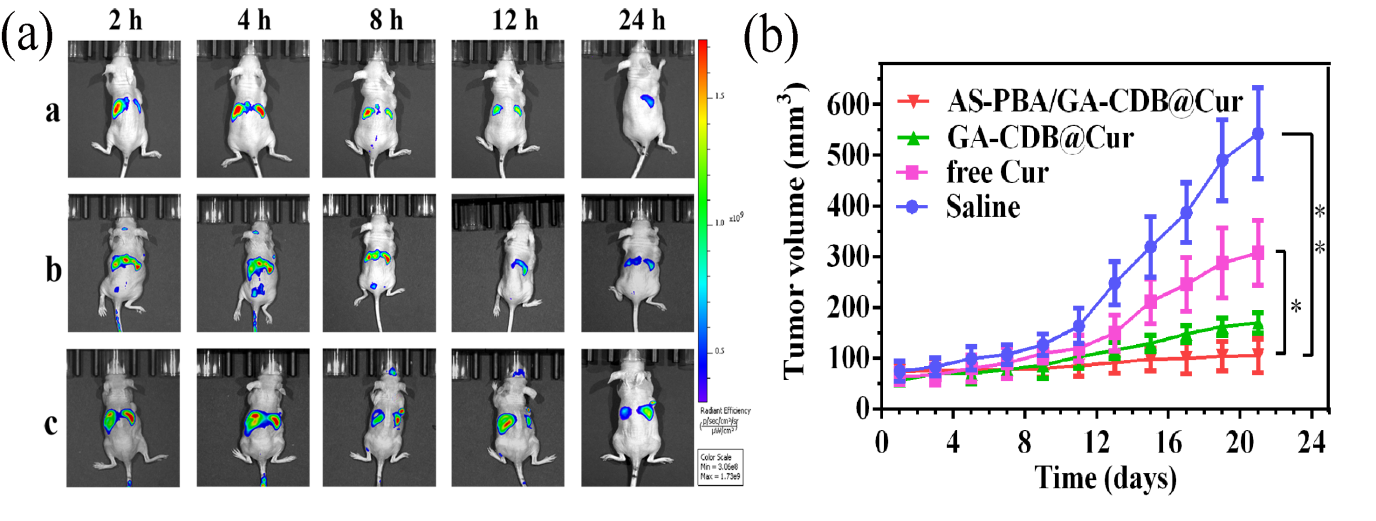
圖5 體內藥物分布(a)及腫瘤抑制效果(b)
相關工作均發表于《Carbohydrate Polymers》。該工作獲得了國家自然科學基金、山東省“泰山學者青年專家”工程、山東省自然科學基金重大基礎研究、山東省優秀青年基金等項目資助。
論文鏈接:
https://doi.org/10.1016/j.carbpol.2019.115787
- 廣西大學林寶鳳教授 IJBM:XSBR介導的生物質聚合物 - 一種解決天然多糖基薄膜低韌性和高親水性的新策略及在食品包裝中的應用 2025-06-23
- 西北師范大學彭輝、馬國富教授團隊 ES&T: 讓空氣直接澆灌莊稼 2025-06-01
- 天大鄭俊萍、德州學院趙靜 Macromolecules:氫鍵增強多糖基凝膠實現高拉伸與裂紋擴展應變 2025-05-22
- 四川大學丁明明教授團隊 Angew: 可視化β折疊到β轉角構象轉變的熒光聚合物囊泡及其用于顏色報告型藥物遞送 2025-07-11
- 山東大學崔基煒教授團隊 ACS Nano: 硬度可調的聚乙二醇納米顆粒調節納米-生物相互作用,增強靶向藥物遞送 2025-06-12
- 浙大周民教授團隊 Bioact. Mater.:微藻藥物遞送系統"降尿酸-抗炎-消化系統保護"三位一體協同用于痛風性關節炎的治療 2025-06-04
- 天工大高輝/馬飛賀/余云健 Small:疏水標簽/低溫光熱協同增強腫瘤治療 2025-07-11
